Indicazioni
Procedura volta ad ottenere un campione di tessuto da una:
- Lesione polmonare non accessibile alla broncoscopia
- lesione già sottoposta a broncoscopica con biopsia ma non diagnositica
- se può essere raggiunto in broncoscopia allora la biopsia transtoracacia diventa una opzione di seconda scelta
- si può decidere di eseguire un'agobiopsia transtoracica anche su lesioni accessibili in EBUS
- dipende dalle disponibilità organizzative del Centro
- dipende dalle preferenze e dalla sicurezza del radiologo interventista
- lesione già sottoposta a broncoscopica con biopsia ma non diagnositica
- Massa mediastinica
- Massa pleurica
con l'obiettivo di:
- Determinare se è una lesione benigna vs maligna
- Confermare istologicamente una sospetta metastasi
- Stadiare la malattia (Staging)
- Profilo molecolare/analisi genomica (Profiling)
- Analisi microbiologica
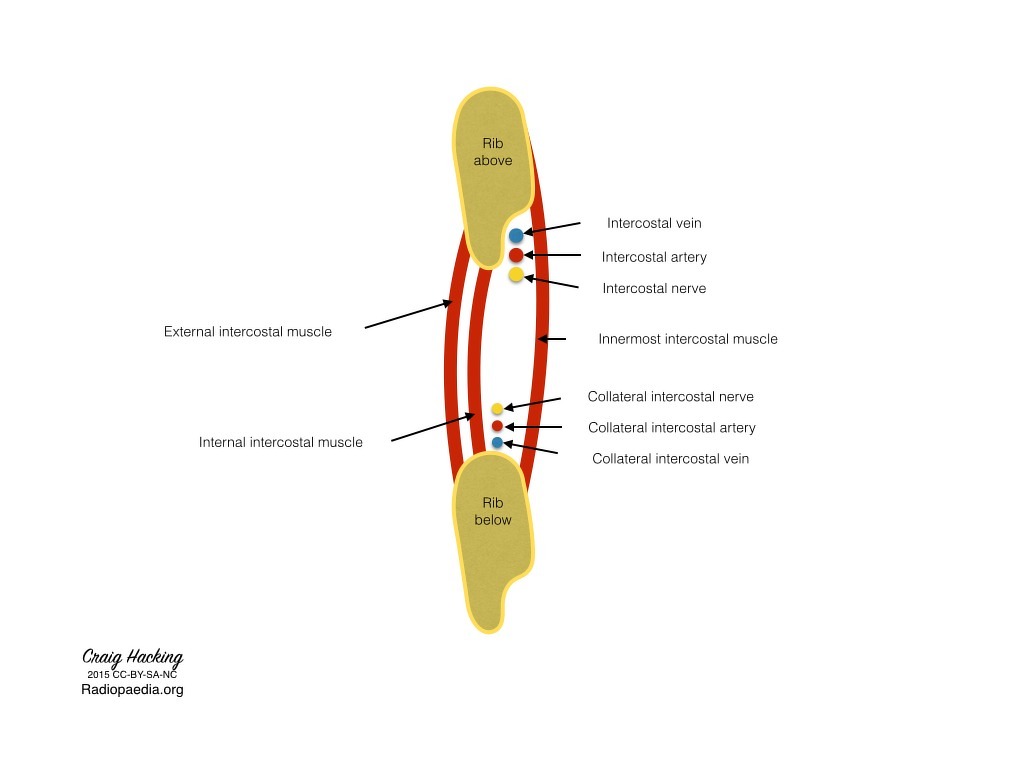
Il vantaggio dell'agobiopsia transtoracica deriva dalla possibilità di utilizzare aghi di maggior calibro (full-core oppure tru-cut 18 G) che aumentano la quantità di materiale prelevato.
Una maggiore quantità di materiale permette di svolgere esami di profilazione molecolare (profiling) della lesione necessaria ai fini di terapia a bersaglio molecolare (target therapy) nel caso di tumori avanzati e in generale non operabili.
Indicazioni all’agobiopsia secondo le Linee Guida della Società di Radiologia Interventistica (SIR):
- Stabilire la natura benigna o maligna di una lesione.
- Ottenere materiale per l'analisi microbiologica in pazienti con infezioni conosciute o sospette.
- Stadiazione della malattia in pazienti con neoplasie conosciute o sospette quando si sospetta diffusione locale o metastasi a distanza.
- Identificare una malattia maligna residua o recidiva dopo l'inizio della terapia.
- Determinare la natura e l'estensione di alcune malattie parenchimali diffuse (come cirrosi epatica, rigetto di trapianto renale, malattia renale medica).
- Ottenere tessuto per l'analisi dei biomarcatori, delle proteine o del genotipo al fine di guidare successivamente la terapia.
- Determinare la cellula di origine primaria in un paziente con malattia metastatica e una neoplasia primaria sconosciuta.
Indicazioni agobiopsia polmonare ecoguidata
- Lesioni polmonari con un contatto pleurico superiore ad un centimetro
- la lesione non deve essere posteriore a strutture ossee
- Lesioni polmonari invasive della parete toracica
Assenza di indicazioni
- L'agobiopsia polmonare percutanea non è indicata per la diagnosi di interstiziopatie polmonari
- il gold standard diagnostico per l'interstiziopatia polmonare è rappresentato dalla biopsia polmonare chirurgica ad oggi eseguita in toracoscopia video-assistita (VATS)
Controindicazioni
- Scarsa funzionalità respiratoria
- Paziente non collobaronate
- Assenza di un punto di acceso sicuro
- Alterazioni della coagulazione
- Cisti da ecchinococco
- rischio di anafilassi
Nello specifico, sono da ritentersi solo come controinducazioni relative:
-
- Enfisema grave
- Maggior predittore di PNX post-bioptico
- Diatesi emorraggica incorregibile
- Assenza di un punto di accesso sicuro
- Ipertensione polmonare severa
- Ventilazione a pressione positiva
- Pneumectomia controlaterale
- Malattia extra-polmonare più facilente accessibile
- Accessibilità broncoscopica
- Nodulo < 1cm di diametro
- controindicazione molto relativa
- Enfisema grave
Il paziente deve essere in grado di rimanere in clinostatismo per 30 minuti, nel caso in cui non fosse in grado questo può rappresentare una controindicazione relativa alla procedura.
(Manhire et al, 2003)
Controindicazioni agobiopsia polmonare ecoguidata
- Lesioni polmonari posizionate posteriormente a strutture costali o ossee in generale
- Lesioni polmonari paravertebrali con superficie di insonazione ultrasonografica insufficiente
Guida alla procedura
Pianificazione della procedura
- Determiare il tragitto migliore:
- percorso più breve
- minimo interessamento pleurico
- passare più perpendicolari possibile alla pleura
- non attraversare le scissure
- evitare
- vasi sanguigni (soprattuto arteriosi)
- bronchi
- bolle di enfisema
Accoglienza del Paziente
Le procedure di agobiopsia polmonare TC guidata necessitano di un periodo di preparazione e osservazione post-procedurale motivo per cui vengono tipicamente svolte in regime di Day Hospital.
- Controllare che le impegnative del paziente siano state registrate
- Agobiopsia Toracica TC guidata
- RX Torace
- Esame citologico
- Valutare i parametri di laboratorio
- PT/INR inferiore a 1,5 (tollerabile fino a 1,8)
- aPTT nei limiti di normalità
- Piastirine superiori a 50 000
- Verificare (chiedere al paziente) che abbia interrotto eventuali terapie anticoagulanti o antiaggreganti
- Interromepere Clopidogrel ed ASA da 5 giorni
- Interromepere NAO da 48 ore (o 72 ore con funzionalità renale ridotta)
- Interromepere EBPM da 24 ore
- Parlare con il Paziente per spiegare la procedura e raccogliere il consenso informato
- il consenso informato è un atto medico e deve essere raccolto dal medico che esegue la procedura
- è importante spiegare la procedura al paziente in modo da tranquillizzarlo e guadagnarne la collaborazione, spiegando che:
- è normale sentire pungere e bruciare durante l'anestesia locale
- dopo l'anestesia continuerà comunque a sentire toccare e premere ma non avvertirà dolore
- è molto importante che mantenga una respirazione spontanea e regolare, senza compiere inspirazioni profonde, demarcando che quando si sentirà dire "fermo non respiri" dovrà arrestare momentaneamente il respiro senza fare inspirazioni profonde
- Valutare l'indicazione all'agobiopsia dalla lettera del GIC/referto della visista oncologica
- Visionare precedenti TC/PET
- localizzare la lesione in modo da decidere l'approccio e indicare come posizionare il paziente al tecnico in modo che possa iniziare ad acquisire lo scout e la scansione pre-procedurale
- approccio anteriore/antero-laterale
- in decubito supino
- in decubito laterale
- approccio posteriore / postero-laterale
- in decubito prono
- approccio anteriore/antero-laterale
- definire/confermare target bioptico:
- visionare l’ultima PET per determinare le regioni maggiormente captanti della lesione al fine di utilizzarle come target
- in assenza di PET visionare l'ultima TC Torace con MdC
- puntare la componente maggiormente iperdensa, tipicamente marginale, della lesione
- evitare le aree ipodense } colliquazione necrotica
- tra due lesioni equivalenti preferire quella più accessibile e con tragitto più breve
- evitare aree della lesione riccamente vascolarizzate (mdc)
- evitare lesioni prossime al diaframma o ai grossi vasi
- localizzare la lesione in modo da decidere l'approccio e indicare come posizionare il paziente al tecnico in modo che possa iniziare ad acquisire lo scout e la scansione pre-procedurale
- su richiesta dell’anatomo-patologo
- misurare dimensione della lesione
- le caratteristiche TC:
- localizzazione polmonare (Polmone - Lobo - Segmento)
- margini rotondeggiandi/spiculati
- densità omogenea/disomogenea
- aderenze fibrotiche scissurali o pleuriche
- enhancement contrastografico
- captazione FDG in SUV
Il valore di SUV (Standardized Uptake Value) è un parametro semi-quantitativo valutabile negli esami FDG-PET/SPECT che indica l’intensità di emissione di una determinata lesione in rapporto alla dose totale iniettata in rapporto alla massa corporea.
Rappresenta un parametro funzionale che suggerisce l’elevata attività metabolica di una struttura o di una lesione. Tipicamente un valore superiore ai 2,5 può indicare una lesione neoplastica.
Un valore di SUV pari a 1 indica un’area con captazione pari al resto dell’organismo.
L'approccio posteriore a paziente prono offre alcuni vantaggi:
- Spazi intercostali di dimensioni maggiori
- La porzione dorsale delle coste si muove meno con la respirazione
- Minor sensibilità nocicettiva della parete toracica dorsale (riduce il dolore del paziente)
- Il paziente non vede l'ago e riduce l'ansia
In letteratura viene suggerito di eseguire una spirometria prima di eseguire una biopsia polmonare per verificare che:
- FEV1 sia maggiore di 35%; acon FEV<35% aumenta il rischio bioptico (insufficiente riserva respiaratoria in caso di PNX) (Manhire et al, 2003)
| NOME COGNOME | Chi è il paziente? |
|---|---|
| IMPEGNATIVE | Ha le impegnative e sono già state registrate? (Agobiopsia TC guidata, esame citologico, RX di controllo) |
| DOCUMENTAZIONE | C'è la relazione dell'oncologo? |
| ESAMI DEL SANGUE | Piastrine, aPTT, PT/INR nella norma? |
| TAMPONE | Tampone molecolare covid negativo? |
| TC | Ha portato o abiamo già la TC più recente? |
| PET | Ha portato o abiamo già la PET più recente? |
| BUSTA, CD, REFERTO | Abbiamo preparato la busta con le etichette stampate, stampato il CD con le immagini della procedura e il referto della pricedura |
Materiale
- marker cutaneo
- guanti sterili
- telo sterile
- telo forato sterile
- lidocaina 8mL + 2mL bicarbonato
- siringa 10mL
- ago 20 per asprazione (bianco)
- ago 22 per inizione (nero)
- Kit coassiale + tru-cut ( 18G x 10 cm | 18G x 15 cm | 18G x 20 cm )
Esecuzione della procedura | guida TC (Metodica non PEARL)
- Monitorare saturazione e frequenza cardiaca del paziente
- E' utile ricordarsi da quali valori parte il paziente, soprattutto nel caso di complicazioni
- Scout
- Scansione iniziale
- Definire tragitto da seguire per giungere al target
- Dopo aver definito il percorso, misurare:
- Distanza tra cute-target } scelta della lunghezza del Tru-Cut
- Distanza tra cute-pleura} scelta dell'ago per l'anestesia locale
- Ago nero 22G cutaneto → 32mm
- Ago spinale 22G → 90mm
- Posizionare griglia
- Definire la sezione (slice) all'altezza della quale si decide di accedere [Asse Z]
- Misurare distanza tra punto di accesso e l'asse planare più vicino
- [Asse X]
- [Asse Y]
- Centratura laser
- Portare il paziente all'altezza della sezione (slice) scelta [Asse Z]
- Misurare la distanza con metro dal laser relativo all'asse scelto [Asse X | Asse Y]
- Segno con pennarello su cute
- Posizionare marker con cerotto adesivo sopra il segno del marker
- Scansione per visualizzare la posizione del repere
- Correggere eventualmente la posizione del repere
Nel caso di lesioni con un tragitto semplice e lineare è possibile decidere di non posizionare il repere ma di iniziare subito con l'anestesia nella localizzazione scelta e lasciare l'ago da anestesia come repere per la scansione successiva.
Così facendo si riducono i tempi e l'irradiazione del paziente.
DA QUI PROCEDERE IN STERILITA’
- Indossare guanti sterili
- L'infermiere esegue la Tricotomia se necessario
- Disinfettare con ChloraPrep
- Posizionare telo forato sterile centrato sul punto di accesso
- Aspirare anestetico
- Siringa luer da 10 mL + Ago bianco 16G
- 8 mL Lidocaina + 2 mL Bicarbonato
- Accedere con ago da anestesia (22G)
- Ago cutaneto da 3 2mm oppure Ago spinale da 90 mm
- Iniettare fino a creare un pomfo cutaneo
- La cute è densamente innervata ed è tra la componenti più sensibili del percorso
- Anestesia del percorso nel sotto cute e nella fascia muscolare
- Aspirare ogni volta che si avanza con l'ago prima di iniettare
- Evita l'iniezione accidentale di lidocaina nei vasi sanguigni
- Non raggiungere la plera ma iniettare solo nei tessuti molli superficiali e soprattuto a livello die piani muscolari
- Aspirare ogni volta che si avanza con l'ago prima di iniettare
- Scansione di controllo mantenendo l'ago da anestesa in sede
- Permette di valutare il percorso prima di posizionare il coassiale
- Nel caso di un percorso difficile si può decidere di mantenere l'ago da anestesia in sede e farne seguire il decorso al coassiale (Tecnica "in tandem")
- Rimuovere l’ago da anestesia
- Posizonare il coassiale lungo il decorso dell’ago da anestesia
- Il coassiale è sempre di 5 cm più corto del Tru-Cut
- Nel caso di un Tru-Cut da 15 cm il coassaile sarà di 10 cm
- Quando si sceglie la lungezza del coassiale si deve sempre considerare:
- Poter arrivare con la punta del coassiale all'interno della lesione
- Poter raggiungere la lesione anche nell'eventualità di un PNX intraprocedurale
- Non scegliere un ago eccessivamente lungo rispetto al percorso da attraversare
- La parte esterna impatta contro il gantry
- Il peso del coassiale con all'interno il Tru-Cut quando si esegue un accesso laterale
- il peso sposta la punta del gantry e modifica l'angolo di accesso dell'ago
- Quando si sceglie la lungezza del coassiale si deve sempre considerare:
- Nel caso di un Tru-Cut da 15 cm il coassaile sarà di 10 cm
- Il coassiale è sempre di 5 cm più corto del Tru-Cut
- Scansione di controllo
- Fare attenzione a non posizionare il coassiale a contatto con la pleura
- I movimenti respiratori porterebbero la punta dell'ago a grattare la pleura } PNX intraprocedurale
- Nel caso di un posizionamento molto prossimo si può decidere di lasciare il coassiale retraendo il mandrino in modo da rimuovere l'elemento tagliente dell'ago
- Per farlo è necessario essere molto sicuri di non essere con l'apice in spazio pleurico } PNX intraprocedurale
- Nel caso di un posizionamento molto prossimo si può decidere di lasciare il coassiale retraendo il mandrino in modo da rimuovere l'elemento tagliente dell'ago
- I movimenti respiratori porterebbero la punta dell'ago a grattare la pleura } PNX intraprocedurale
- Fare attenzione a non posizionare il coassiale a contatto con la pleura
- Caricare l’ago Tru-Cut
- Decidere il numero di scatti in base alla dimensione della lesione e alla vicinanza di strutture nobili
- 1 scatto (10 mm)
- 2 scatti (20 mm)
- Decidere il numero di scatti in base alla dimensione della lesione e alla vicinanza di strutture nobili
- Rimuovere il mandrino del coassiale
- Dopo aver rimosso il mandrino tappare il canale con un dito
- Fare attenzione a preservare la posizione del coassiale senza estrarlo o spingerlo all'interno durante la procedura
- tappare il foro del coassiale
- riduce il rischio di embolia gassosa
- preserva la pressione intrapleurica diminuendo il rischio di PNX e impedisce gli scambi d'aria tra interno ed esterno minimizzando il rischio di infezione.
- tappare il foro del coassiale
- Fare attenzione a preservare la posizione del coassiale senza estrarlo o spingerlo all'interno durante la procedura
- Dopo aver rimosso il mandrino tappare il canale con un dito
- Accedere con ago Tru-Cut attraverso il lume del coassiale
- Arrivati alla pleura aprire il tru-cut, esistono diverse tecniche
- Aprire direttamente la cemera del tru-cut
- Ha il vantaggio di dare percerpire meglio la consistenza della lesione ed essere sicuri di averla presa
- Può portare la lesione a spostarsi nel parenchima facendo passare l'ago affianco ad essa
- In questi casi in linea di massima è preferibile ritrarre la camera dopo il controllo e riaprirlo nella giusta direzione
- In alcuni casi si può decidere di "caricare la lesione" ruotando la camera verso la lesione e inclinando l'asta dell'ago nella direzione della lesione in modo da schiacciarla contro la camera del tru-cut e quindi scattare
- Colpire con il dito sul grilletto in modo da permettere un accesso graduale nella lesione
- E' una tecnica molto più sicura rispetto ai vasi
- Nel caso in cui si incontri resistenza e risposta elastica con ritorno verso l'esterno della camera tra un colpo e l'altro non forzare; è un segno suggestivo di struttura vascolare } prevenire emorragia
- Eseguire un controllo ed evventualmente aprire a fianco del precedente percorso
- Nel caso in cui si incontri resistenza e risposta elastica con ritorno verso l'esterno della camera tra un colpo e l'altro non forzare; è un segno suggestivo di struttura vascolare } prevenire emorragia
- E' una tecnica molto più sicura rispetto ai vasi
- Aprire direttamente la cemera del tru-cut
- Scansione di controllo
- Valutare la posizione della punta dell’ago
- Allertare il patologo che si sta per "scattare"
- Rientrare in sala
- Informare il paziente che sentirà lo scatto di una molla e di non preoccuparsi
- Scattare con il tru-cut
- Uscire con il tru-cut
- Tappare con dito il foro del coassaile
- Riposizionare il mandrino del coassiale a 3/4
- In questo modo il canale del coassiale è sigillato ma la punta del mandrino e interna al canale e non può ledere i tessuti
- Far eseguire scansione di controllo
- Spostarsi alla postazione dei patologi
- Ricaricare il tru-cut di 2 scatti
- Indipendentemente dal numero di scatti fatto per acquisire
- Posizionandosi sopra la spugna far avanzare la punta del tru-cut senza farlo scattare
- Imprinting su vetrino
- Scorrere il frustolo sul vetrino in modo da depositare alcune cellule
- Cercare di depositare un buon numero di cellule in modo aumentare la possibilità che il prelievo risulti idoneo alla valutazione del patologo
- Scorrere il frustolo sul vetrino in modo da depositare alcune cellule
- Depositare il frustolo di tessuto sulla spugnetta
- Ruotare di 3/4 in modo da facilitare il distacco del frustolo
- Il materiale deve essere preferibilmente disteso e integro
- Non toccare niente con i guanti o il tru-cut } Rimanere sterili
- Ruotare di 3/4 in modo da facilitare il distacco del frustolo
- Mentre i patologi valutano l’idoneità della biopsia controllare la scansione di controllo per PNX o emorragia
- Se richiesto secondo campione ripetere la procedura ruotando eventualmente il tru-cut di 180° al secondo scatto per evitare di scattare a vuoto
- Valutare sempre attentamente con i patologi l'esecuzioni di eventuali ulteriori acquisizioni bioptiche (scatti) valutando l'utilità e gli eventuali rischi/benefici
- Lesione singola operabile } Chirurgia
- Sufficiente confermare se è neoplastica o meno
- Non serve molto materiale
- Se alla valutazione estemporanea rilevabili cellule neoplastiche non dovrebbero essere necessarie altre acquisizioni
- Lesione non operabile } Terapia a bersaglio molecolare vs immunoterapia vs chemioterapia
- Necessario più materiale (≥2 prelievi) per l'immunoistochimica e la profilazione molecolare (Profiling)
- Sufficiente confermare se è neoplastica o meno
- Discutere con il patologo la necessità di ulteriore materiale in relaizione alle caratteristiche di accessibilità bioptica della lesione:
- elevato rishio emorraggico
- localizzata in una zona prossima a strutture anatomiche nobili
- lesione subcentimetrica
- Lesione singola operabile } Chirurgia
- Valutare sempre attentamente con i patologi l'esecuzioni di eventuali ulteriori acquisizioni bioptiche (scatti) valutando l'utilità e gli eventuali rischi/benefici
- Se non sono richiesti ulteriori campioni e al controllo post-biopsia si evidenzia una falda di PNX procedere all' aspirazione della falda prima di uscire con il coassiale
- Nel caso di falda di rilievo con scollamento del polmone
- tentare aspirazione del PNX con agocanuala 14G, linea di estesione con rubinetto tre-vie e siringa luer da 60 mL
- allertare la chirurgia toracica per pianificare il posizionamente di un tubo di drenaggio
- Nel caso di falda di rilievo con scollamento del polmone
- Se al controllo post procedura si evidenzia una voluminosa soffusione emorragica somministrare acido trancexamico (Tranex)
- solitamente una fiala, nel caso di sanguinamenti importanti e paziente privo di fattori di rischio trombotici si procede a somministrare due fiale
- Nel caso di emottisi rilevante e desaturazione del paziente allertare broncoscopia in urgenza per aspirare il sanguinamento
- Se richiesto secondo campione ripetere la procedura ruotando eventualmente il tru-cut di 180° al secondo scatto per evitare di scattare a vuoto
- Uscire con tru-cut insieme al coassiale
- Tamponare immediatamene con forza la zona interessata
- Dopo la procedura controllare per PNX o soffusione emorragica.
- Indicare al paziente di rimanere sdraiato per 2 ore dopo la procedura
- in questa maniera si riduce il rischio di PNX
- Nel caso di importante emorragia indicare emocromo di controllo a 2 ore
- Indicare comunque RX del torace di controllo a 2 ore
- in letteratura viene indicato di eseguire il controllo RX tra le 2 e le 4 ore
- L'esame RX permette di valutare
- PNX
- importante espansione della soffusione emorragica
- emotorace
Controllare con una scansione ogni volta che si posiziona l’ago, il pazinte si può essere mosso nel frattempo
Esecuzione della procedura | guida ecografica
- Valutazione ecografica lesione target
- ecogenicità
- dimensione
- localizzazione
- ecocolordoppler (vascolarizzazione)
- Valutazione del percorso di approccio
- evitare assi vascolari
- la puntura vasi interposti può indurre un ematoma
- evitare le arterie intercostali
- la puntura delle arterie intercostali può indurre un emotorace
- evitare parenchima polmonare
- la puntura polmonare può indurre pneumotorace
- evitare assi vascolari
- Segno con marker cutaneo sulla sede di puntura individuata
- Disinfezione con clorexidina su garza
- Lavare con fisiologia sterile gli aghi } riduce la presenza di aria che peggiora l’immagine ecografica
- lavare canale del coassiale con fisiologica
- lavare la camera del tru-cut
- Anestesia
- ago da 22G
- siringa luer-lock da 10mL
- 9 mL di lidocaina
- 1 mL di bicarbonato
- Posizionamento coassiale fino alla lesione
- Sostituire pungente del coassiale con ago tru-cut
- Far avanzare lentamente l’ago lungo il coassiale } riduce l’ingresso di bolle d’aria
- Agobiopsia con ago tru-cut 18G
- Riposizionare il pungente nel canale del coassiale per 3/4 della lunghezza
- impedisce l’ingresso di aria (prevenendo l’insorgenza di PNX) e permette di mantenere la punta del coassiale smussata per non grattare la pleura
- Imprinting su vetrino
- L’idoneità con valutazione estemporanea anatomo-patologica aumenta significativamente la sensibilità diagnostica della procedura
- Prima di estrarre il coassiale riposizionare il pungente
- Estrarre coassiale con pungente
- Medicazione semplice
Refertazione
Referti prefatti: guida TC
Con guida TC ed approccio anteriore destro è stata eseguita la biopsia sulla nota lesione polmonare omolaterale utilizzando ago di TRU-CUT 18-15 cm (_ preliev_).
Alla valutazione estemporanea anatomo-patologica il prelievo risulta idoneo.
Non si evidenziano complicanze maggiori immediate segnalando minima soffusione perilesionale.
Si consiglia controllo a 2 ore dal termine della procedura con radiografia del torace.
Termine della procedura ore: 9:40.
All'acquisizione basale pre-procedurale odierna si osserva regressione pressoché completa dell'addensamento parenchimale precedentemente descritto tra segmento antero-basale e apicale del lobo inferiore del polmone sinistro (ridistribuiti nell'emitorace in esiti di lobectomia superiore omolaterale), dove residuano esili strie dense di aspetto disventilativo; si soprassiede pertanto all'agobiopsia transtoracica prevista.
All’acquisizione basale pre-procedurale odierna si osserva regressione dell’addensamento parenchimale precedentemente descritto al livello segmento anteriore del lobo superiore del polmone di sinistra dove residuano esili strie dense di aspetto disventilativo; si soprassiede dunque all’agobiopsia transtoracica prevista.
Con guida TC ed approccio posteriore destro è stata eseguita la biopsia sulla nota lesione polmonare del segmento superiore del lobo inferiore omolaterale utilizzando ago di TRU-CUT 18-15 cm (1 prelievo). Comparsa di limitata falda di PNX intraprocedurale completamente risolta dopo drenaggio al termine della procedura.
Non si evidenziano complicanze maggiori immediate.Si consiglia controllo a 2 ore dal termine della procedura con radiografia del torace.
Con guida TC ed approccio anteriore a destra è stata eseguita la biopsia sul noto, esteso, consolidamento parenchimale polmonare omolaterale utilizzando ago di TRU-CUT 18-15 cm (1 prelievi).
Durante la procedura si rileva comparsa di falda di pneumotorace che viene efficacemente drenata.
Non si rilevano alterazioni dei parametri vitali con riscontro di stabilità dei valori di SaO2 in aria ambiente.
Al termine della procedura permane falda di pneumotorace anteriore destro di circa 15 mm.
Si consiglia monitoraggio clinico e controllo a 2 ore dal termine della procedura con radiografia del torace.
Termine della procedura ore: 12.00
Nonostante plurimi tentativi (eseguiti a paziente supino, anche valutando l'approccio con arti addotti), non è stato possibile portare a termine la procedura bioptica, dapprima per la difficoltà a centrare la
lesione (molto "mobile" con gli atti respiratori), quindi per sopraggiunta reazione vagale del paziente stesso.
Si è quindi deciso di interrompere al momento ulteriori manovre bioptiche, eventualmente ripetibili dopo l'esito della PET-CT già programmata.
Il controllo al termine della procedura ha dimostrato una minima falda di pneumotorace saccato a prevalente distribuzione antero-caudale, modesta e stabile a distanza di circa 15 minuti (utile il consueto ricontrollo radiografico tra circa 2 ore).
Ore 10:00
Sotto guida TC è stato effettuato un tentativo di biopsiare la nota nodularità subpleurica antero-mediale nel lobo medio (paracardiaca), con approccio antero-laterale; la tosse scuotente indotta da una minima soffusione emorragica lungo il tragitto dell'ago (Paziente all'interruzione dell'antiaggregazione piastrinica da meno di 24 ore) e associata a un'esile falda di pneumotorace ha indotto a interrompere la procedura, anche per l'impossibilità del Paziente a fornire un'adeguata collaborazione.
Appare pertanto ragionevole rivalutare in ambito multidisciplinare il successivo iter diagnostico-terapeutico.
Sotto guida TC, con approccio anteriore, è stata effettuata l'agobiopsia (mediante duplice campionamento con ago Tru-Cut semiautomatico del calibro di 18G inserito in cannula coassiale) della piccola nodularità polmonare escavata già nota nel segmento anteriore del lobo superiore sinistro.
Il materiale prelevato è stato inviato all'esame anatomo-patologico, il cui esito sarà disponibile al più presto.
Il controllo TC immediatamente al termine della procedura non ha evidenziato complicanze immediate; a distanza di pochi minuti, per l'insorgenza di algie acute, è stato però effettuato un nuovo controllo, con dimostrazione di una falda di pneumotorace relativamente ingravescente (nonostante un duplice tentativo di drenaggio estemporaneo con ago-cannula), poi autolimitatosi.
Si attende pertanto il controllo radiografico a distanza di 2 ore prima di decidere l'ulteriore gestione dello pneumotorace.
In esiti di recente biopsia transtoracica, si osserva falda di pneumotorace apico-parieto-basale sinistra con spessore massimo in regione apicale di circa 5 cm.
In regione paracardiaca al campo polmonare medio di sinistra si osserva una formazione nodulare radiopaca riferibile alla nota lesione sottoposta ad accertamento bioptico.
Non si osservano lesioni parenchimali addensanti a carico dell'emitorace di destra né falde di versamento pleurico.
L'ombra cardiomediastinica ha dimensioni nei limiti della normalità.
La trachea è in asse.
Esame eseguito in regime di urgenza con quesito clinico: controllo post drenaggio pnx
Esame eseguito in singola proiezione con paziente in posizione seduta.
Rispetto al precedente controllo RX eseguito in data odierna alle ore 13:31, si riconosce posizionamento di drenaggio pleurico a a sinistra con accesso in corrispondenza del V spazio intercostale ed apice proiettivamente in corrispondenza del III arco costale con netta riduzione della falda di PNX dello spessore attuale massimo di circa 5 mm in sede apicale e una buona riespansione del parenchima polmonare.
Persistono alcune strie disventilative in sede epifrenica sinistra.
Sono noti ed immodificati tutti i restanti reperti.
È disponibile in consultazione in archivio digitale PACS l'iconografia relativa al precedente studio radiografico del 27/06/2022 effettuato a Paziente in postura assisa.
L'indagine attuale è stata acquisita in ortostasi nelle due proiezioni ortogonali.
Tenendo in conto le differenze tecniche non si apprezzano sostanziali modificazioni.
Con guida TC ed approccio anteriore parasternale sinistro è stata eseguita, utilizzando ago TRU-CUT 18-10 cm (2 prelievi), l'agobiopsia sulla nota lesione ovalare a margini netti del mediastino anteriore di dimensione assiale massima di 5cm.
Alla valutazione estemporanea anatomo-patologica il prelievo risulta idoneo.
Non si evidenziano complicanze maggiori al temine della procedura.
Nel periodo di osservazione il Paziente presenta dolore ingravescente al torace in sede di biopsia esacerbato dagli atti ventilatori pur mantenendo parametri vitali stabili (SaO2% > 92%); viene eseguito controllo TC che evidenzia lieve falda di PNX sinistro del diametro assiale massimo di 3cm.
Vengo somministrati 1000mg di paracetamolo endovenoso e soluzione fisiologica.
Indicato controllo a 2 ore dal termine della procedura con radiografia del torace.
Termine della procedura ore: 10:30
Referti prefatti: guida ecografica
Sotto guida ecografica è stata eseguita l’agobiopsia mediante duplice campionamento con ago Tru-Cut semiautomatico del calibro di 18G di una delle nodularità polmonari periferiche subpleuriche già note, situata in prossimità del recesso costo-frenico destro, solida ipoecogena lievemente disomogenea, rotondeggiante, del diametro massimo di almeno 3.5 cm.
Il materiale prelevato è stato inviato all’esame anatomo-patologico, il cui esito sarà disponibile al più presto.
Il controllo ecografico al termine procedura non ha evidenziato complicanze immediate; la Paziente è stata pertanto rinviata a domicilio.
Sotto guida ecografica, mediante ago Tru-Cut semiautomatico del calibro di 18G e tecnica coassiale, è stata effettuata l’agobiopsia con triplice campionamento della porzione periferica della nota massa polmonare nel lobo superiore destro, interessante tutto il segmento anteriore e infiltrante la parete toracica tra regione mammaria e linea ascellare anteriore omolaterale.
Il materiale prelevato è stato inviato all’esame citologico, il cui esito sarà disponibile al più presto.
Il controllo ecografico al termine procedura non ha evidenziato complicanze immediate.
Controllo post-procedura
- Dopo la procedura di agobiopsia toracica tc guidata il paziente deve rimanere in osservazione per 2 ore
- in letteratura vengono indicati periodi dalle 2 alle 4 ore
- Dare l'indicazione a rimanere supino e non alzarsi
- al fine di prevenire la formazione o lo spandimento di falde di PNX
Referti prefatti RC di controllo
RX TORACE | CONTROLLO NEGATIVO
In esiti di recente agobiopsia polmonare percutanea non evidenti falde di pneumotorace né di versamento pleurico.
Trachea in asse.
Al campo polmonare _____ di _______ nota formazione nodulare radiopaca riferibile alla lesione sottoposta ad accertamento bioptico.
Ombra cardiaca nei limiti di normalità.
Complicazioni
- Pneumotorace (PNX)
- la complicazione più comune (incidenza dal 8 al 64% delle procedure - mediamente 20%)
- Emoraggia alveolare (5-17% - mediamente 20%)
- Emottisi (1-5%)
- Embolia gassosa
- Embolia sistemica (0.2%)
Dopo la biopsia, nel caso sia presente una limitata falda di pneumotorace indicare al paziente di rimanre sdraiato sul lato su cui è stata eseguita la biopsia.
Dranaggio intraprocedurale di pneumotorace (PNX)
Se durante la procedura emerge una limitata falda di PNX al termine della procedura si prende una siringa luer da 20L raccordata ad in cavo di raccordo con rubinetto tre vie e l'operatore sterile monta i componenti sul coassiale con il tre vie sul lato della siringa. Estrarre il coassiale aspirando e fermarsi ogni volta che si aspira aria (buttando poi fuori 'aria dalla siringa aprendo il rubinetto tre vie quando semette di tirare) e riprendere a uscire ogni voltra che si èsotto vuoto e non spira più. Uscire in aspirazione e medicare.
Nel caso di voluminosa falda di PNX prima di aver completato la biopsia
- Ricostruzione sagittale dell'ultima acquisizione
- Evidenziare il punto anti-declive più elevato pungibile in sicurezza
MANTENERE CAMPO DI STERILITA'
- Pungere con agucanula 16G
- Rimuovere pungente lasciando la canula in sede
- Raccordare l'agocanula al catetere con tre-vie preventivamente montato sulla siringa da 20 mL
- Tenere la siringa in aspirazione a pressione negativa
- Quando vengono aspirati ingenti volumi di aria si procede a
- Chiudere il canale verso la pleura sul rubinetto a tre-vie
- Svuotare di aria la sirigna attraverso il canale a tre-vie-verso l'esterno
- Richuedere il canale verso l'esterno
- Aspiare dallo spazio pleurico
- Ripetere fintantoché non si resta in aspirazione con pressione negativa (lo stantuffo fa resistenza in aspirazione)
- Quando vengono aspirati ingenti volumi di aria si procede a
- Muovere la canula in varie direzioni fintantoché non riprende ad aspirare
- Provare a retrarre lievemente la canula per aspirare porzioni maggiormente anti-declivi di pneumotorace.
Indicare alla paziente di rimanere sdraiata supina nelle prossime ore, senza mettersi seduta, senza eseguire movimenti bruschi o dare colpi di tosse.
Eseguire RX di controllo a 2 ore.
Esame estemporaneo anatomo-patologico (Rapid On Set Evaluation - ROSE)
- Il frustolo, ancora contenuto nella camera del tru-cut, viene strisciato su vetrino in modo da depositare del materiale cellulare per permettere la valutazione citologica estemporanea } Imprinting
- Nel caso in cui il materiale depositato sul vetrino sia eccessivo si prende un secondo vetrino e si striscia sopra il primo vetrino } "Striscio"
- Il frusto bioptico viene depositato sulla spugna
- Il Patologo può aiutare tenendo ferma la spugna con le pinzette
- Assicurarsi di non aver lasciato materiale nella camera del tru-cut
DA QUI IN POI PARTE DELL'ANATOMO-PATOLOGO
- I vetrini dell'imprinting vengono fissati immergendoli in metanolo per 10 secondi
- Far colare il metanolo in eccesso su di un fazzoletto
- Successivamente i vetrini vengono immersi in esosina per 10 secondi
- Far colare l'eosina in eccesso su di un fazzoletto
- Successivamente i vetrini vengono immersi in ematossina per 15 secondi
- Far colare l'ematossina in eccesso su di un fazzoletto
- Sciaquare 10 secondi in acqua
- Asciugare il retro e i bordi del vetrino
- Visionare al microscopio
- Se al vetrino sono evidenziabili cellule con caratteristiche displastiche o francamente neoplastiche viene dato il giudizio di idolenità del campione alla successiva diagnosi } Idoneità
- Nel caso di imprinting idoneo ma di quantità ridotte di materiale può venir richiesto il prelieovo di un altro frustolo per aumentare la quantità del campione } Arricchimento
- Nel caso di materiale non indeoneo si decide se si è i sicurezza a procedere con l'acquisizione di un altro frustolo oppue se si decide di terminare la biopsia
- Un imprinting non idoneo non significa che il frustolo non sarà diagnostico, è possibile che il frustolo contenga materiale diagnostico
- Una non idoneità può essere legata ad uno striscio poco efficace sul vetrino
- Valutare anche l'integrità e le caratteristiche del materiale del frustolo
- Un imprinting idoneo altresì non significa che il frustolo sarà diagnostico, è possibile che il frustolo non contenga materiale diagnostico anche se ciò è meno probabile
- Un imprinting non idoneo non significa che il frustolo non sarà diagnostico, è possibile che il frustolo contenga materiale diagnostico
- I frustoli raccolti vengono chiusi tra due spugnette e vengono chiusi nelle camerette in plastica
- Le camerette contenenti i frustoli vengono inserite negli apposti contenitori da biopsia
- Immergere la cameretta nella soluzione fisiologica nella porzione inferiore del contenitore
- Chiudere avvitando la prozione inferiore del contenitore contenente la cameretta con i frustoli
- Svitare la porzione superiore del contenitore contenente formalina che si riverserà nella porzione inferiore
- Riavvitare la porzione superiore in modo impedire fuoriuscita di liquido
- Mescolare delicatamente il contenuto
- Etichettare con nome e dati del paziente
- Scrivere il referto con i dati clinici, le caratteristiche radiologiche della lesione su Armonia.
L'esame estemporaneo è una valutazione citologica nella quale è possibile valutare esclusivamente la presenza di cellule displastiche ma non le caratteristiche ultrastrutturali della lesione.
Le caratteristiche cellulari che fanno propendere per una diagnosi di neoplasia sono:
- Cellule di dimensioni incrementate
- Ipercromasia
- Nuclei di grosse dimensioni
- Rapporto Nucleo/Citosol elevato
- Elevato numero di nucleoli
- Citosol ipercromico
- Distorsioni della morfologia cellulare
- Presenza di filamenti di citosol
- L'agoaspirato percutaneo del polmone presenta un'elevata senisibilità e specificità per le lesioni maligne comparabile all'agobiopsia
- L'agoaspirato percutaneo ha invece sensibilità e specificità inferiori rispetto all'agobiopsia per le lesioni benigne. (Connor et al, 2000)
- L'agobiopsia presenta un'accuratezza maggiore della FNAB (67-90% vs 59-81%) (Yao et
al, 2012) - L'agobiopsia polmonare TC-guidata presenta accuratezza, sensibilità e specificità rispettivamente del 93%, 95% e 96% (Yang et al. 2015)
- L'agobiopsia permette inoltre di ottenere una valutazione non solo citologica ma anche anatomo-patologica.
- profilazione molecolare
- EGRF
- valutazione di sensibilità a immunoterapia
- profilazione molecolare
Bibliografia
- Md, B. W. C. (2017). Diagnostic Imaging: Interventional Procedures (2nd ed.). Elsevier.
- https://radiopaedia.org/articles/ct-guided-thoracic-biopsy
- Reid, C. E., & Wallis, A. G. (2017). Percutaneous image-guided lung biopsy.
British Journal of Hospital Medicine, 78(12), C178–C182.
doi:10.12968/hmed.2017.78.12.c178
Raccolta di immagini
Classificazione di Wolfman et al. del pneumotorace in TC
Wolfman NT, Myers WS, Glauser SJ, Meredith JW, Chen MY. Validity of CT classification on management of occult pneumothorax: a prospective study. AJR Am J Roentgenol. 1998 Nov;171(5):1317-20. doi: 10.2214/ajr.171.5.9798871. PMID: 9798871.