Embolizzazione arterie bronchiali
Descrizione
- L’emottisi grave (Severe Haemoptysis, SH) è un’emergenza respiratoria associata ad un alto tasso di mortalità del 50-100%
- la causa della morte è solitamente l'asfissia e non il sanguamento
- nel 90% dei casi il sanguinamento ha origine dalla circolazione bronchiale
- solo nel 5% dei casi origina dalla circolazione polmonare
- oppure nel restante 5% dei casi dalla circolazione sistemica non bronchiale
- la soglia per definire l'emottisi grave varia tra 200 e 1000 mL in 24-48h
- poiché negli adulti il volume totale delle vie aeree conduttrici è in media di 150 mL, qualsiasi emorragia nelle vie aeree può diventare rapidamente pericolosa per la vita
Definizione di emottisi
- Definizione di emottisi1, 2:
- Lieve:
- <100 mL/giorno oppure <50 mL/episodio
- Moderata:
- 100–300 mL/giorno (≈ 1 tazza)
- alta mortalità potenziale
- richiede un trattamento precoce
- può causare asfissia
- Grave:
- qualsiasi emottisi che provochi >100 mL in 24 ore
- oppure responsabile di insufficienza respiratoria (SpO2 < 60%) con necessità di intubazione o ventilazione meccanica
- oppure responsabile di instabilità emodinamica
- Lieve:
Eziologia dell’emottisi grave
Nei paesi sviluppati le più comuni cause di emottisi sono il cancro del polmone, la tubercolosi attiva, le bronchiectasie e l'aspergillosi (80%) mentre nel 15-20% dei casi non risulta possibile identificare la causa del sanguinamento.
- Tubercolosi
- Bronchiectasie (fibrosi cistica)
- Ascesso
- Polmonite cronica
- Aspergilloma (isolato o con malattia polmonare cronica preesistente)
- Carcinoma polmonare (comprese metastasi)
- Fibrosi interstiziale polmonare cronica
- Malattia polmonare cronica ostruttiva (BPCO)
- Bronchite cronica
- Pneumoconiosi
- Malformazione dell'arteria polmonare (PAVM), Rasmussen o aneurisma micotico
- Emottisi criptogenica
- Trattamento anticoagulante
Alternative terapeutiche
- Broncoscopia, rappresenta sempre la prima linea terapeutica
- Le opzioni chirurgiche a cielo aperto devono essere intraprese urgentemente nei casi in cui:
- l'emorragia delle arterie polmonari è causata da un processo polmonare distruttivo
- cancro del polmone
- polmonite necrotizzante
- micetoma polmonare
- fallimento di altre tecniche
- l'approccio chirurgico non può essere impiegato nell'emottisi criptogenetica3
- l'emorragia delle arterie polmonari è causata da un processo polmonare distruttivo
- Quando è impossibile procedere ad un'embolizzazione efficace e il sanguinamento si ripresenta entro 72 ore dopo la procedura si dovrebbe prendere in considerazione un intervento chirurgico d'urgenza
Broncoscopia
Nei pazienti instabili, dove il trasferimento non è sicuro e l'intubazione e l'isolamento polmonare sono della massima importanza, la broncoscopia flessibile è la procedura di scelta e può essere eseguita al capezzale del letto4
Se la broncoscopia non è prontamente disponibile in un paziente clinicamente stabile, non si dovrebbe ritardare il trasferimento del paziente in TC per la localizzazione dell’emorragia e una successivo trasferimento ad embolizzazione2
- La broncoscopia consente:
- l'estrazione del coagulo
- l'instillazione diretta di farmaci
- il tamponamento
- l'ablazione delle arterie emorragiche
- supporta l'intubazione selettiva per mantenere la pervietà delle vie aeree
Acronimi e sinonimi
- Embolizzazione di arteria bronchiale
- Bronchial Artery Embolisation
- BAE
Indicazioni
L'embolizzazione è indicata in tutti i pazienti con emottisi ricorrente o dove questa rappresenti un rischio per la vita del paziente e in cui si osservino arterie patologiche.
- Qualsiasi emottisi che causi una significativa compromissione delle vie aeree o difficoltà respiratoria
- ≥3 episodi di emottisi con >100 mL di sangue nell'arco di 1 settimana
- Episodi di sanguinamento cronici o a lento incremento
- tali piccoli sanguinamenti spesso precedono un’emottisi massiva che pericolosa per la vita del paziente (Life-Threatening Haemoptysis, LTH)
L'embolizzazione può anche rappresentare un trattamento ponte per i pazienti con emottisi moderata o grave causata da malattie polmonari infiammatorie croniche come la fibrosi cistica, eventualmente trattabili con trapianto polmonare.
Flowchart della diagnosi e del trattamento dell’emottisi
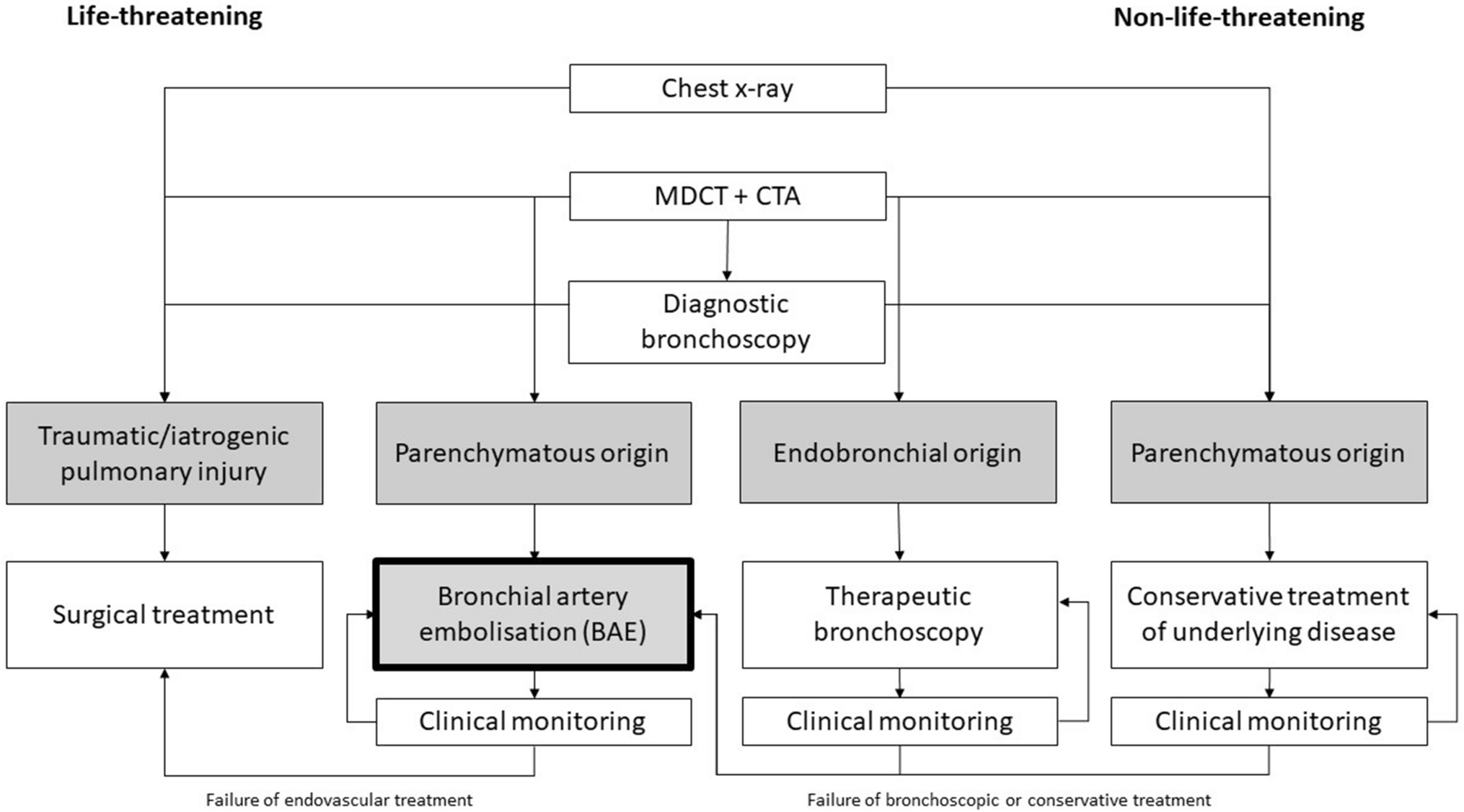
Controindicazioni
- Controindicazione assoluta
- Embolizzazione di un ramo arterioso (vasi bronchiali, intercostali o altri vasi non bronchiali) da cui si diramano vasi che si dirigono al cuore, al midollo spinale o al cervello
- Controindicazione relativa
- Stenosi congenita dell'arteria polmonare
- i vasi collaterali bronchiali possono svolgere un ruolo essenziale nella perfusione del parenchima polmonare
- Stenosi congenita dell'arteria polmonare
Preparazione del paziente
Valutazione del caso
- Il sospetto di emottisi deve essere confermato
- Deve essere stabilita la gravità dell'emottisi
- Deve essere individuata l'origine del sanguinamento
- per una buona gestione dell’emottisi, tutte le arterie patologiche devono essere embolizzate
- quando la lesione responsabile non viene identificata è necessario procedere ad embolizzazione bilaterale delle arterie bronchiali
- Deve essere determinata la causa del sanguinamento
Esami di laboratorio
- Emocromo
- Emoglobina (Hb)
- Piastrine (PLTs)
- Profilo di coagulazione
- aPPT
- PT/INR
- Funzionalità renale
- eGFR (CKD-EPI)
Imaging
- Una TC del torace senza mezzo di contrasto identifica la causa e la sede del sanguinamento nell'82-100% dei casi
- sufficiente su pazienti con espettorato striato di sangue e sospetta bronchiectasia
- I pazienti con espettorato striato di sangue e fattori di rischio (fumatore, BPCO) o con reperti patologici alla radiografia del torace necessitano di una TC con mezzo di contrasto
- I pazienti con emottisi severa e sanguinamento attivo richiedono un Angio-TC, dalla base del collo alle arterie renali, per identificare un apporto arterioso non bronchiale prima dell'embolizzazione
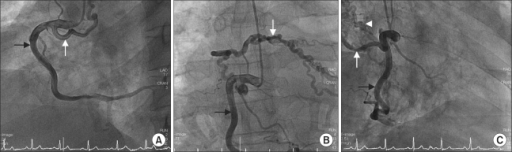
Aspetto angiografico e TC delle arterie bronchiali anomale
In un soggetto sano, il diametro dell'arteria bronchiale all'ostio misura 1,6 ± 0,3 mm con un range di 1,1–3,0 mm6
- Ipervascolarizzazione del parenchima polmonare (più comune)
- Arterie bronchiali o non bronchiali tortuose ipertrofiche (comune)
- Neovascolarizzazione (comune) o ipervascolarizzazione peri-bronchiale
- Arteria bronchiale principale ingrandita (diametro >2mm)
- Stravaso di mezzo di contrasto (possibile)
- Aneurisma dell'arteria bronchiale, pseudoaneurisma (raro)
- Shunt delle vene bronchiali-polmonari
- Ispessimento pleurico > 3mm adiacente ad un'anomalia parenchimale
- Ipertrofia del grasso extrapleurico comprese le strutture vascolari allargate
Preparazione del paziente
- A meno che non sia necessario un intervento immediato, come nel caso di emottisi pericolosa per la vita, i parametri della coagulazione e lo stato emodinamico devono essere ottimizzati prima dell'intervento ed è consigliabile un digiuno di 3-6 ore
- Posizionare un accesso venoso di grosso calibro per la somministrazione di fluidi ed eventuale trasfusione di sangue
Materiali
- Introduttore
- 5Fr 12cm
- 5Fr 45cm
- Filoguida
- Stater del kit
- Filo guida idrofilico 0,035" 180cm (tipo Terumo)
- Catetere selettivo
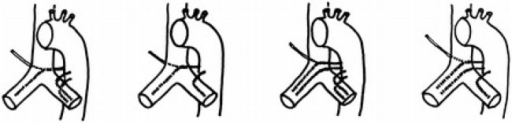
- Shepherd-Hook
- Simmons 1
- curva più stretta , più adatto ad aorte strette
- Simmons 2
- curva più ambia, più adatto ad aorte larghe
- AL1
- catetere cardiologico
- Cobra
- Sidewinder
- Mikaelsson
- Microcatetere
- Renegade (Boston Scientific)
- Headway 21 (MicroVention Terumo)
- Microsiringa luer-lock in policarbonato da 1mL/3mL
- facilità l'iniezione di soluzione fisiologica o contrasto attraverso il microcatetere
- Filoguida per microcatetere
- Whisper Hi-Torque (Abbott)
- Materiale extra
- Valvola ad Y
- Deflussore per sacca a pressione
- Embolizzante
- Contour 355-550
- Contour 500-710
- Ciotolino e singa non luer da 5mL decicati per l'embolizzante
Esecuzione della procedura
- Disinfezione con Chloraprep
- Anestesia locale con Lidocaina se paziente non in sedazione generale
- Puntura arteria femorale comune
- Filo guida starter
- Controllo radiografico del sito di puntura
- Introduttore 4-5Fr
- breve 12cm
- in alternativa in caso di ostio complesso possibile utilizzare introduttore lungo 45cm per ottenere maggiore stabilità
- se possibile è preferibile un introduttore lungo
- Filo guida idrofilico 0,038" 180cm (tipo Terumo) fino all'arco aortico
- Catetere diagnostico
- AL1
- Cobra
- Simmons 1
- Simmons 2
- Sidewinder
- Mikaelsson
- Shepherd-Hook
- Iniezione manuale di MdC lungo la parete dell'aorta per visualizzare arteria bronchiale
- in assenza di una precedente Angio-TC o in caso di difficoltà ad individuare le arterie bronchiali
- è possibile eseguire un aortogramma flush per identificare i collaterali sistemici bronchiali e non bronchiali
- dovrebbe essere presa in considerazione l’angiografia delle arterie succlavie, nel caso di sanguinamento in sede apicale
- per determinare l’origine di arterie bronchiali ectopicheda arterie toraciche interne o da tronchi tireocervicali
- in assenza di una precedente Angio-TC o in caso di difficoltà ad individuare le arterie bronchiali
- Appoggiare il catetere all'ostio dell'arteria
- Fluorografia diagnostica con iniezione manuale di MdC
- Angiografia a sottrazione per Road-Map
- Filo guida idrofilico in arteria bronchiale selezionata
- Portare catetere con apice all'interno dell'arteria bronchiale
- Collegare il catetere tramite valvola da Y e rubinetto tre-vie a sacca a pressione (soluzione fisiologica lisca) per mantenere in lavaggio
- Microcatetere (tipo Headway / Renegade) con filoguida per microcatetere (tipo Whisper)
- oppure in alternativa PX SLIM Delivery Microcatheter (Penumbra) + Synchro SELECT SUPPORT STRAIGHT 0,014" x 215 cm
- oppure in alternativa Microcatetere (Headway DUO) 167 cm
- Fluorografia diagnostica selettiva dei rami dell'arteria bronchiale selezionati con microcatetere
- valutare l'assenza di circoli collaterali del vaso con arterie anomale
- anastomotiche con i vasi cardiaci
- anastomotiche con arterie del midollo spinale
- arteria spinale anteriore
- si presenta come immagine a livello mediano prossimalmente ai processi spinosi
- il flusso nell'arteria spinale tipicamente sia in direzione craniale che caudale
- fare attenzione alle possibile anastomosi con l'arteria radicolare magna di Adamkiewicz
- tipicamente emerge dalle radicolari di D9-D12 e non dovrebbe interessare direttamente le arterie bronchiali
- arteria spinale anteriore
- valutare l'assenza di circoli collaterali del vaso con arterie anomale
- Roadmap
- Embolizzazione con particelle o spirali o plug vascolari
- Particelle non sferiche di PVA, con un diametro di 355–500 µm (Contour)
- particelle più piccole (< 300 μm) possono occludere il regolare apporto di sangue ai bronchi, all'esofago, ai vasa vasorum dell'arteria polmonare o all'aorta
- aumento del rischio di eccessiva ischemia tissutale e necrosi
- pertanto non possono essere utilizzate nell'embolizzazione delle arterie bronchiali
- inoltre esiste il rischo che particelle di diametro inferiore superino il filtro capillare e possano andare a embolizzare a distanza nel circolo sistemico
- aumento del rischio di eccessiva ischemia tissutale e necrosi
- a causa della loro forma non uniforme, le particelle di PVA possono aggregarsi
- provocano un'embolizzazione prematura prossimale rispetto al target
- potrebbe portare a emottisi ricorrente da collaterali sistemici
- questo rischio può essere ridotto posizionando la punta del microcatetere il più vicino possibile alla sede del sanguinamento
- potrebbe portare a emottisi ricorrente da collaterali sistemici
- provocano un'embolizzazione prematura prossimale rispetto al target
- particelle più piccole (< 300 μm) possono occludere il regolare apporto di sangue ai bronchi, all'esofago, ai vasa vasorum dell'arteria polmonare o all'aorta
- in alternativa, è possibile utilizzare qualsiasi tipo di particella a microsfere calibrate (300–900 μm)
- hanno dimensioni e caratteristiche di penetrazione più uniformi rispetto al PVA
- la loro superficie liscia con rivestimento idrofilo è meno soggetta ad aggregarsi all'interno dei cateteri
- in aggiunta è possibile posizionare piccole quantità di gelatina sotto forma di pezza o impasto denso dopo gli agenti particolati per completare l'embolizzazione
- il suo utilizzo come unico agente non è duraturo e quindi non raccomandato
- quando sono presenti grandi shunt arteriosi o venosi polmonari è possibile prevenire complicazioni ricorrendo a:
- microsfere di tris-acrilico di dimensioni maggiori (700-900 μm)
- l'embolizzazione con spirale
- l'impiego di spirali compromette la possibilità di ripetere un'embolizzazione per emottisi ricorrenti
- la spirale può migrare a valle del vaso
- Particelle non sferiche di PVA, con un diametro di 355–500 µm (Contour)
- Preparare le microsfere in una bacinella apposita
- segnare la bacinella per riconoscerla (per es: immergerci tappo del Contour)
- versare 50mL di MdC orgnaoidato + 50mL di Soluzione Fisiologica (diluizione 1:1) in catetere da 0,021" (2,5 Fr) per fiala intera di Controur 355-550
- oppure in alternativa versare 40mL di MdC orgnaoidato + 25mL di Soluzione Fisiologica in catetere da 0,021" (2,5 Fr) per 2/3 di Controur 355-550
- versare 20mL di MdC orgnaoidato + 20mL di Soluzione Fisiologica (diluizione 1:1) in catetere da 0,021" (2,5 Fr) per mezza fiala di Controur 150-250
- aumentare o meno la diluizione in base alla dimensione del microcatetere
- spargere le microsfere all'interno della bacinella
- segnare la bacinella per riconoscerla (per es: immergerci tappo del Contour)
- Mescolare con siringa da 5mL non luer
- usare una siringa diverse dalle altre presenti sul tavolo
- non luer permette di girare la siringa lungo l'imbocco del microcatetere durante l'iniezione
- Iniettare microparticelle attraverso il microcatetere
- Inserire siringa
- aspirare per rimuovere eventuali microbolle di aria
- iniettare con siringa in orizzontale in modo da non far precipitare le particelle
- ruotare la siringa durante l'iniezione in modo da non far precipitare le particelle
- controllare in floroscopia la progressiva opacizzazione dell'arteria e l'assenza di reflusso
- interrompere l'inizione in caso di reflusso
- Lavare con alcuni mL di fisiologica dopo 1-2 iniezioni
- Ripetere fino alla completa occlusione del vaso
- all'occlusione del vaso si inizia ad osservare rallentamento del flusso durante l'iniezione
- presenza di reflusso
- Nel caso di dubbi sul possibile persistere di sanguinamento è possibile chiudere il vaso distalmente dopo l'embolizzazione con Contour con delle spirali
- Spirali 4 mm x 2 mm tipo (Ruby Coil | Penumbra)
- 2 o 3 spirali brevi impilate
- Spirali 4 mm x 2 mm tipo (Ruby Coil | Penumbra)
- Rimozione del microcatetere
- Fluorografia diagnostica finale da catetere
- documenta la corretta occlusione del vaso
- Portare fuori il catetere
- Rimozione introduttore
- documentare con scopia la corretta posizione dell'introduttore e la presenza di flusso prima di rimuoverlo
- Compressione manuale
- 13-15 min per 5Fr in paziente normotipo
- Medicazione compressiva
Refertazione
- Introduzione
- Procedura eseguita in Paziente con emoftoe e riscontro di sospetto pseudoaneurisma adiacente ad un bronco tributario per il segmento posteriore del lobo inferiore a destra.
- Setting
- Procedura eseguita in regime d'urgenza.
- Accesso
- Accesso arterioso percutaneo ecoguidato retrogrado femorale comune destro (6 F).
- Accesso arterioso percutaneo ecoguidato retrogrado femorale comune destro (5 F).
- Accesso vascolare ecoguidato arterioso femorale destro e sinistro (5 F) e venoso femorale destro (5 F).
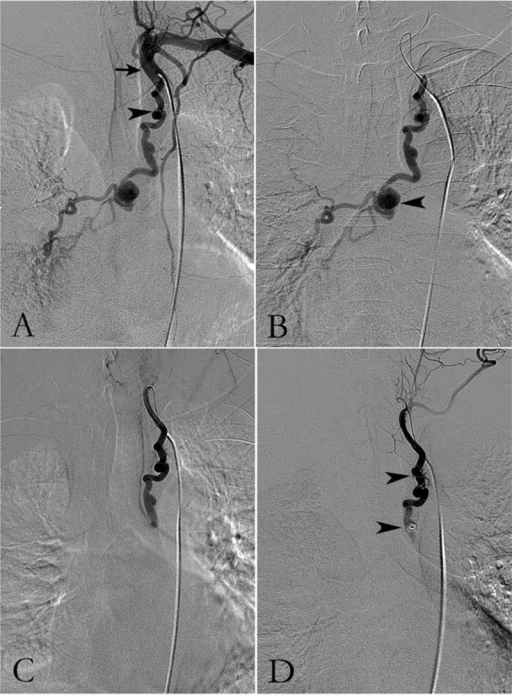
- Angiografia diagnostica
- Sulla scorta di quanto evidenziato alla broncoscopia ed all'indagine angio-TC eseguite precedentemente in giornata, si cateterizza l'arteria bronchiale destra e si eseguono i controllo angiografici preliminari che evidenziano, ubiquitariamente nei tre lobi polmonari, la presenza di multipli rami arteriosi ipertrofici con circoli distali patologici e fistole artero-arteriose.
- Si cateterizza l'arteria intercostale suprema di destra e si eseguono i controlli angiografici che evidenziano, a partire dalla stessa, l'origine di un'arteria bronchiale accessoria per il lobo polmonare superiore, ipertrofica e anch'essa caratterizzata dalla presenza di fistole artero-arteriose distali.
- I controlli angiografici preliminari documentano estrema ectasia e tortuosità delle arterie bronchiali destra e sinistra, originanti da un lungo tronco comune, con presenza di multipli circoli patologici intraparenchimali polmonari bilaterali, più rappresentati in corrispondenza del lobo superiore di destra, con rapidi e cospicui "shunt" tra il circolo arterioso bronchiale ed il circolo arterioso polmonare.
- Previo cateterismo selettivo della tronco bronchiale principale di destra, è stata eseguita arteriografia anche mediante cateterismo superselettivo con microcatetere microguida dei rami lobari per il lobo medio ed inferiore che dimostra spandimento extraluminale di MDC riferibile a sanguinamento arterioso attivo a partenza dalla ramo per il lobo medio.
- Previo cateterismo selettivo dell'arteria bronchiale destra, ipertrofica e tortuosa, si eseguono i controlli angiografici preliminari che, proiettivamente in corrispondenza del lobo polmonare inferiore omolaterale, documentano la presenza di un circolo patologico con fistole artero-arteriose nel contesto di verosimile natura infiammatoria cronica; si conferma la presenza di un aneurisma da "stress" a livello ilare.
- Si cateterizza quindi selettivamente l'arteria bronchiale sinistra, anch'essa tortuosa ed ipertrofica, e si eseguono i controlli angiografici preliminari che anche da questo lato, proiettivamente in corrispondenza del lobo polmonare inferiore, documentano la presenza di un circolo patologico con fistole artero-arteriose nel contesto di verosimile natura infiammatoria cronica.
- Previo cateterismo selettivo dell'arteria bronchiale di destra si esegue l'angiografia che non evidenzia significativi circoli ipertrofici, "shunt" artero-arteriosi o artero-venosi né spandimenti attivi di mdc nel lume bronchiale; si rilevano invece alcune esili afferenze arteriose verso una formazione nodulare in campo polmonare inferiore di destra, lateralmente, verosimile causa dell'emottisi della Paziente anche alla luce delle precedenti recenti indagini TC.
- Angiografia diagnostica rotazionare (CBCT | 3D-RA | Vaso-CT)
- Previo cateterismo selettivo dell'arteria polmonare destra e superselettivo del ramo arterioso tributario del lobo medio e del lobo inferiore si esegue studio angiografico anche nelle diverse proiezioni oblique, completato anche con acquisizione rotazione durante iniezione di mdc dall'arteria polmonare destra. L'arteriografia non ha documentato chiare immagini di spandimenti extraluminali di mdc riferibili né malformazioni vascolari ad alto flusso. Lo studio angiografico delle due arterie bronchiali, ad origine indipendente, ha documentato la presenza di circuito vascolare patologico a partenza dalla bronchiale più craniale che raggiunge la piramide basale omolaterale.
- Embolizzazione
- Mediante microcatetere e microguida si cateterizza superselettivamente distalmente sino in sede ilare l'arteria bronchiale destra e si procede alla sua embolizzazione mediante iniezione di microparticelle di PVA (Contour 500-710 micron).
- Mediante microcatetere e microguida si cateterizza superselettivamente distalmente tale arteria e si procede alla sua embolizzazione mediante iniezione di microparticelle di PVA (Contour 500-710 micron).
- Si cateterizza il tronco bronchiale comune il più distalmente possibile compatibilmente con le tortuosità vasali e si procede all'embolizzazione mediante spirali metalliche a rilascio controllato (Ruby Penumbra).
- Compatibilmente con l'anatomia vascolare della Paziente è stata eseguita embolizzazione mediante microparticelle embolizzanti (Contour 45-150 micron) dell'arteria per il lobo medio senza risultato soddisfacente. È stata quindi eseguita pertanto embolizzazione del tronco tributario per il lobo medio - inferiore e di parte del lobo superiore per la presenza di ramo ricorrente, mediante utilizzo di microspirali a rilascio controllato.
- Si cateterizza superselettivamente, mediante microguida e microcatetere, più distalmente l'arteria bronchiale destra stessa e si procede alla sua embolizzazione mediante iniezione di microparticelle di PVA (Contour 500-710 micron).
- Previa navigazione distale, mediante microcatetere e microguida, si esegue embolizzazione con iniezione di una miscela di microparticelle (Contour 355-500 micron).
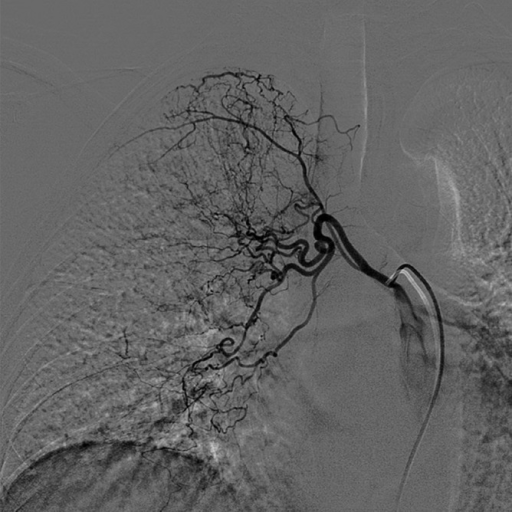
- Angiografia di controllo
- I controlli angiografici successivi documentano la completa deafferentazione distale del vaso trattato senza più evidenza dei circoli patologici bronchiali sovradescritti.
- I controlli angiografici eseguiti al termine documentano il buon esito della procedura con completa deafferentazione arteriosa bronchiale, senza ulteriore opacizzazione dei circoli patologici e degli shunt sovradescritti.
- Il controllo finale documenta buon esito della procedura con devascolarizzazione dell'afferenza trattata e senza altri spandimenti extraluminali di MDC riferibili a ulteriori sanguinamenti attivi.
- Emostasi
- Complicanze
- Non complicanze intraprocedurali.
- Non complicanze periprocedurali.
- Al termine della procedura la Paziente presenta alcuni accessi di tosse stizzosa e lamenta sensazione di prurito alla gola. Nell'ipotesi di reazione allergica al mdc si procede ad infusione e.v. di metilprednisolone 125 mg, con risoluzione della sintomatologia. Mdc utilizzato: Iomeron 350 mg/ml; iniettati 80 ml durante la procedura. Si raccomanda di eseguire profilassi antiallergica qualora fosse necessario l'impiego di mdc in futuro.
- Indicazioni
- Indicato monitoraggio della sede dell'accesso vascolare inguinale destro.
- Indicata domani valutazione pneumologica ed eventuale broncoscopia, se indicata a giudizio dello specialista. Utile eventuale rivalutazione TC prima del trasferimento presso l'Ospedale di prevenienza previa sempre valutazione dello specialista pneumologo.
- Indicazioni:
- immobilità dell'arto inferiore destro e sinistro per almeno 8 ore;
- gestione di entrambi i Safeguard secondo istruzioni allegate in cartella;
- monitoraggio clinico-laboratoristico.
Referti prefatti
Consenso informato raccolto in forma scritta e allegato al presente referto.
Con accesso arterioso femorale dx (5Fr) è stato eseguito cateterismo selettivo dell'arteria bronchiale dx che appare ipertrofica; lo studio angiografico condotto da tale livello conferma l'evidenza angio-TC di un circolo patologico rifornito da rami apicali e localizzato in corrispondenza dei noti esiti di pregressa infezione specifica.
Con microcatetere e microguida si esegue cateterismo superselettivo dei rami afferenti a tale circolo patologico e si procede quindi ad embolizzazione degli stessi con miscela di Glubran e Lipiodol 1:3 fino alla devascolarizzazione quasi completa della lesione.
Al successivo controllo post-embolizzazione residua una porzione della lesione iniziale, con dimensione ridotta a meno del 25%, rifornita da un piccolo ramo non cateterizzabile per dimensioni e disposizione, nonostante i ripetuti tentativi. Si sospende pertanto la procedura.
Si esegue emostasi dell'accesso femorale con sistema MynxGrip.
Non si evidenziano complicanze periprocedurali.
Si indica controllo Angio-TC a distanza di 6 mesi, salvo diversa indicazione clinica.
Gestione clinica peri-procedurale
- Spesso i pazienti con sanguinamento delle arterie bronchiali sono affetti da BPCO, la quale rappresenta anche la causa dei circoli bronchiali patologici e dei sanguinamenti, quindi possono presentare una saturazione precaria e possono necessitare di ossigeno
- Nel caso di paziente non compliante possibile eseguire blanda sedazione con pochi mg di midazolam (1-2mg)
Complicanze
- Sindrome post-embolizzazione (dolore, febbre, leucocitosi)
- Dolore al petto
- Disfagia
- Dissezione subintimale o perforazione dell'arteria bronchiale
- Complicazioni del sito di accesso
- Necrosi aortica e bronchiale
- Lesione del nervo frenico
- Infarto polmonare
- Infarto spinale e mielite trasversa
- Ischemia transitoria, ictus, cecità corticale
- Angina/infarto miocardico
- Insufficienza respiratoria e morte
Mortalità
- La mortalità nel ricovero iniziale durante il primo episodio di emottisi varia tra il 4 e il 16%
- La mortalità per tutte le cause di emottisi durante 3 anni di follow-up è del 27%
- La mortalità per tutte le cause di emottisia 5 anni di follow-up è del 22%
Controllo post-procedurale
- Valutare la scomparsa dell'emottisi a seguito della procedura
- al persistere dell'emottisi dopo embolizzazione delle arterie bronchiali è possibile che la causa sia legata a un arteria non bronchiale
- Nei pazienti affetti da malattia polmonare cronica come la fibrosi cistica è possibile che sia necessario ripetere l'embolizzazione ogni 2-3 per la ripresa del sanguinamento da vasi collaterali che rivascolarizzano la regione coinvolta
- le successive vascolarizzazioni presentano un rischio incrementato di embolizzazione di strutte non target
- L'impiego di antifibrinolitici come l'acido tranexamico possono essere utili nella gestione dell'emottisi ricorrente di minore entità
- Quando è impossibile procedere ad un'embolizzazione efficace e il sanguinamento si ripresenta entro 72 ore dopo la procedura si dovrebbe prendere in considerazione un intervento chirurgico d'urgenza
Successo tecnico
- Il successo tecnico è definito come la capacità di cateterizzare ed embolizzare le arterie bronchiali o non bronchiali anomale responsabili del sanguinamento
- le percentuali di successo tecnico variano dal 90 al 100%
Successo clinico
- Il successo clinico è definito come la completa cessazione dell’emorragia o una riduzione significativa dell’emottisi dopo embolizzazione senza richiedere ulteriori interventi
- nel 82-100% si ottiene un successo clinico per almeno 24 ore
- nel 70–92% si ottiene un successo clinico per almeno 30 giorni
Follow-up nel tempo dopo la procedura
Raccolta casi clinici
- Ragazzo 23 anni con fibrosi cistica nota in terapia, non comorbidità o altre terapie, emottisi ingravescente da 6 mesi, non difficoltà respiratorie né sintomi. Lievi aree di GGO al lobo superiore destro. Embolizzazione con Contour 355-550 di arteria bronchiale patologica destra (4mm).
- Uomo di 65 anni affetto da BPCO con lunga storia di forte tabasimo (>50p/y), episodio di grave emottisi con difficoltà respiratorie nella notte, arteria bronchiale con emergenza atipica dall'arteria anonima di destra
- Giovane uomo di 30 anni originario del Pakistan con emottisi in noto quadro di caverna polmonare da TBC, risanguinamento dopo pregressa embolizzazione della stessa caverna.
Bibliografia
- Kettenbach, J., Ittrich, H., Gaubert, J.Y. et al.
CIRSE Standards of Practice on Bronchial Artery Embolisation.
Cardiovasc Intervent Radiol 45, 721–732 (2022).
https://doi.org/10.1007/s00270-022-03127-w - Parrot A, Tavolaro S, Voiriot G, et al.
Management of severe hemoptysis.
Expert Rev Respir Med. 2018;12(10):817-829.
doi:10.1080/17476348.2018.1507737 - The Endovascular Today European Device Guide
- Panda, A., Bhalla, A. S., & Goyal, A. (2017). Bronchial artery embolization in hemoptysis: a systematic review. Diagnostic and interventional radiology (Ankara, Turkey), 23(4), 307–317. https://doi.org/10.5152/dir.2017.16454 ↩︎
- Davidson, K., & Shojaee, S. (2020). Managing Massive Hemoptysis. Chest, 157(1), 77–88. https://doi.org/10.1016/j.chest.2019.07.012 ↩︎
- Kervancioglu, S., Bayram, N., Gelebek Yilmaz, F., Sanli, M., & Sirikci, A. (2015). Radiological findings and outcomes of bronchial artery embolization in cryptogenic hemoptysis. Journal of Korean medical science, 30(5), 591–597. https://doi.org/10.3346/jkms.2015.30.5.591 ↩︎
- Davidson K, Shojaee S. Managing Massive Hemoptysis. Chest. Published online January 2020:77-88. doi:10.1016/j.chest.2019.07.012 ↩︎
- Kettenbach J, Ittrich H, Gaubert JY, Gebauer B, Vos JA. CIRSE Standards of Practice on Bronchial Artery Embolisation. Cardiovasc Intervent Radiol. Published online April 8, 2022:721-732. doi:10.1007/s00270-022-03127-w ↩︎
- Yener Ö, Türkvatan A, Yüce G, Yener A. The normal anatomy and variations of the bronchial arteries: evaluation with multidetector computed tomography. Can Assoc Radiol J. 2015;66(1):44-52. doi:10.1016/j.carj.2014.07.001 ↩︎