Chemioembolizzazione Epatica (TACE)
Nomenclatura
- TransArterial Embolisation (TAE)
- Embolizazione dei vasi arteriosi che riforniscono il tumore senza impiego di farmaco
- TransArterial ChemoEmbolisation (TACE)
- Embolizazione dei vasi arteriosi che riforniscono il tumore con associata somministrazione di chemioterapico
- Conventional TACE (c-TACE)
- Somministrazione di emulsione di lipiodol e chemioterapico seguita da embolizzazione convenzionale
- Drug-Eluting Microsphere transarterial chemoembolisation (DEM-TACE)
- Somministrazione di microsfere permanenti caricate con chemioterapico
- Degradable Starch Microsphere transarterial chemoembolisation (DSM-TACE)
- Somministrazione di microsfere degradabili caricate con chemioterapico
- Balloon-occluded transarterial chemoembolisation (b-TACE)
- Somministrazione di microsfere caricate con chemioterapico o chemioterapico emulsionato con lipiodol a seguito di occlusione del vaso con pallone su catetere microvascolare
Indicazioni
Le indicazioni attuali per la TACE includono il trattamento di tumori primitivi e secondari del fegato quali
- Epatocarcinoma (HCC)
- le lesioni di epatocarcinoma (HCC) > 3 cm sono spesso associate alla necessità di trattamenti multipli
- l'interessamento tumorale al 50% del volume epatico è correlato a una prognosi sfavorevole
- Colangiocarcinoma Intraepatico (ICC)
- colangiocarcinomi intraepatici non resecabili o non operabili con malattia limitata solo al fegato o a predominanza epatica
- Metastasi da Carcinoma del Colon (mCRC)
- nei pazienti con malattia limitata al fegato in cui le linee chemioterapiche disponibili hanno fallito
- Metastasi da tumori neuroendocrini (NET)
Gli obiettivi della TACE possono essere:
- ridurre il carico tumorale totale entro i criteri di trapianto (down-staging)
- controllare la crescita del tumore in un paziente in lista d'attesa per il trapianto (bridging)
- aumentare la sopravvivenza nei pazienti non idonei al trapianto (palliativo)
La TACE può anche essere considerata come terapia alternativa alla resezione chirurgica delle metastasi epatiche nei pazienti con NET e come alternativa al trattamento sistemico in quei pazienti con NET con malattia limitata al fegato.
Controindicazioni
- Controndicazioni assolute
- Trombosi neoplastica della vena porta
- Flusso sanguigno epatofugo
- Funzione epatica compromessa (Child-Pugh B8 o superiore)
- Stato di salute compromesso (ECOG P2 o superiore)
- Controindicazioni per l'arteriografia
- trombocitopenia non correggibile
- coagulopatia
- grave insufficienza renale
- reazione allergica grave a mezzo di contrasto
- Controindicazioni relative
- TIPS
- Trombosi della vena porta non neoplastica segmentale o subsegmentale
Pazienti con un carico tumorale che supera il 50% del volume epatico difficilmente trarranno beneficio dal trattamento.
Materiali
- Particelle embolizzanti con chemioterapico (DEM-TACE)
- HepaSphere (Merit)
- LifePearl (Terumo)
- Embocure Plus (Balton)
- Embozene Tandem (Varian)
- Microsphere (Invamed)
Preparazione per la procedura
- Studio imaging e tipizzazione per diagnosi della lesione epatica
- la TC o la RM sono in grado di stabilire diagnosi di HCC nei pazienti cirrotici in lesioni > 10 mm
- a seguito della diffusione della medicina di precisione l'accordo in letteratura per la biopsia di un sospetto HCC sta crescendo
- negli altri tumori (metastasi da k colon, colangiocarcinoma intraepatico, tumori neuroendocrini), in genere si preferisce effettuare una biopsia confermativa prima di pianificare una TACE
- la TC o la RM sono in grado di stabilire diagnosi di HCC nei pazienti cirrotici in lesioni > 10 mm
- Almeno uno studio imaging dinamico con mezzo di contrasto (TC o RM) dovrebbe essere eseguito prima di una TACE, preferibilmente entro un mese prima della procedura per valutare:
- anatomia vascolare (preferibile TC)
- identificazione delle varianti anatomiche della vascolarizzazione epatica
- individuazione dei vasi che alimentano la neoplasia
- dimensioni e numero di lesioni epatiche
- diffusione extraepatica
- presenza di controindicazioni assolute e/o relative per la TACE
- presenza di trombosi della vena porta
- fattori predisponenti l'ascesso epatico
- dilatazione dell'albero biliare
- litiasi biliare/colecisti
- protesi biliari (plastiche, metalliche)
- anastomosi bilioenterica
- shunt portosistemico intraepatico transgiugulare (TIPS)
- anatomia vascolare (preferibile TC)
Preparazione del farmaco
Preparare sotto cappa di aspirazione biologica in contesto sterile
(la siringa delle HepaSphere con Doxorubicina verrà poi trasportata sul tavolo sterile durante la procedura)
Materiale
- 1 flacone di doxorubicina 50 mg (in 25mL)
- Aghi 18G
- 1 siringa da 50 mL o più grande
- 1 flacone di microsfere HepaSphere
- 1 tappo per siringa
Passaggi di preparazione
- Aprire il flacone di microsfere HepaSphere
- prestare attenzione a non rimuovere il tappo o l'anello metallico
- per mantenere la sterilità avvolgere preventivamente il flacone con tegaderm
- Rotolare il flacone di microsfere HepaSphere più volte per disperdere le microsfere
- Con una siringa luer da 50 mL e un ago 18G, prelevare 25mL di doxorubicina presolubilizzata (a temperatura ambiente)
- Iniettare 10 mL di doxorubicina presolubilizzata nel flacone di microsfere HepaSphere
- Ruotare e invertire delicatamente il flacone di microsfere HepaSphere avanti e indietro 5-10 volte,
- Lasciare riposare il flacone per 10 minuti
- agitare ogni tanto
- Dopo 10 minuti, prelevare l'intero contenuto del flacone di microsfere HepaSphere in una siringa da 50 mL (o 20mL) contenente il resto della soluzione di doxorubicina (27,5 mL)
- Agitare delicatamente
- Rimuovere l'ago e tappare la siringa
- Attendere due o
- mantenere la siringa immobile in posizione verticale senza capovolgerla per permettere la precipitazione delle sfere per gravità
Preparazione del paziente
Giorno precedente alla procedura
- inibitore della secrezione gastrica ranitidina (Ranidil)
Giorno della procedura
- Premedicazione endovenosa con 8mg di Ondansetron, 8mg di Betametasone e 40mg di pantoprazolo (polvere infusionale).
- in alternativa è possibile somministrare ad inizio procedura diluiti in un unico flacone da 100mL di soluzione fisiologica
- 1 fiala di omeprazolo (40mg)
- 1 fiala da 4mg di ondanstentron (Zofran) ad inzio procedura oppure in alternativa 1 fiala da 5mg di tropisetron (Navoban)
- 1 fiala da 10mg di morfina
- in alternativa alla morifina è possibile somministrare indicativamente 50mcg di Fentanyl ad inizio procedura
- somministrare altri 50mcg di Fentanyl prima dell'inserimento delle particelle embolizzanti trattate con chemioterapico
- tipicamente di gestione dell'anestesista del servizo di NORA
- Possibileesguire profilassi antibiotica con cefazolina (Totacef) endovena 2g ogni 12 ore il giorno della procedura e i 3 giorni successivi
- In caso di marcato sovvertimento epatico è possibile ricorrere a terapia con deltacortene in compresse per evitare la febbre a seguito del trattamento e proteggere il fegato dall'effetto tossico delle sostanze liberate dalla citonecrosi seguendo lo schema:
- iniziare con 10mg x 2 volte al giorno per i primi 10 gioni (ore 8 e ore 20)
- successivamente 5 mg x 2 volte al giorno per i 5 giorni seguenti (ore 8 e ore 20)
- infine 2,5 mg x 2 volte al giorno per gli ultimi 5 giorni (ore 8 e ore 20)
- Nel caso di trattamento in sedazione può essere somministrato midazolam (ipnovel) con piccoli boli da 0,5mg fino ad una dose massima di 5mg
- attento monitoraggio dell'attività respiratoria, nel caso di apnea somministrare antidoto
- Flumazenil (Anexate) in fiale da 1mg/10mL da somministrare alla dose di 0,2mg al primo bolo con successivi boli da 0,1mg ogni 30 secondi fino al raggiungimento dello stato di coscenza desiderato
- evitare sovradosaggio per possibile iperestesia e agitazione del paziente
- Flumazenil (Anexate) in fiale da 1mg/10mL da somministrare alla dose di 0,2mg al primo bolo con successivi boli da 0,1mg ogni 30 secondi fino al raggiungimento dello stato di coscenza desiderato
- attento monitoraggio dell'attività respiratoria, nel caso di apnea somministrare antidoto
Esecuzione della procedura
- Disinfezione con Chloraprep
- Campo sterile
- Anestesia locale con 10mL di lidocaina
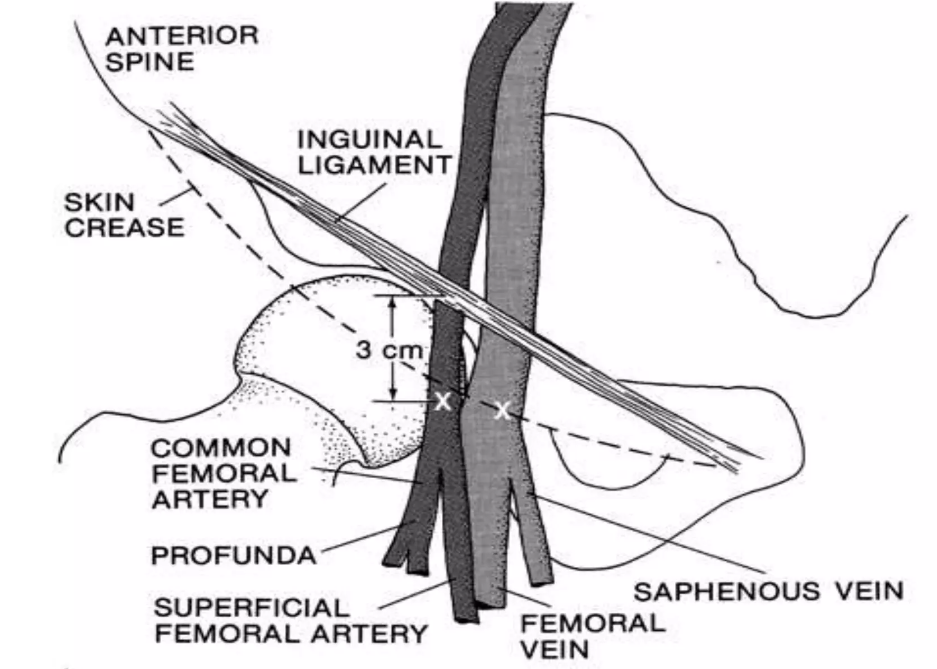
- Accesso vascolare arterioso con puntura retrograda
- puntura dell'arteria femorale comune con ago vascolare 18G
- Fluorografia di controllo del sito di puntura
- Filo guida Bentson
- Introduttore vascolare 5Fr
- Catetere Shepherd Hook 5Fr
- in alternativa catetere Cobra 5Fr
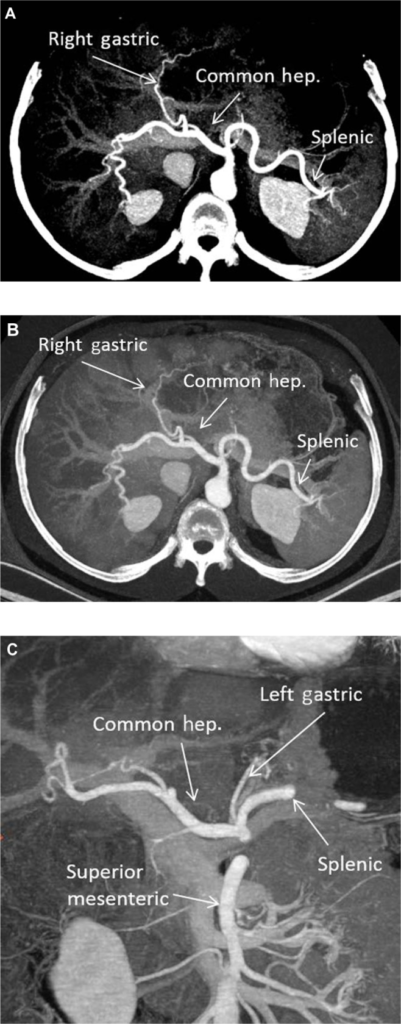
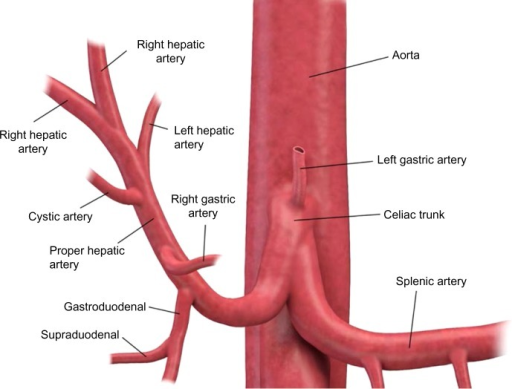
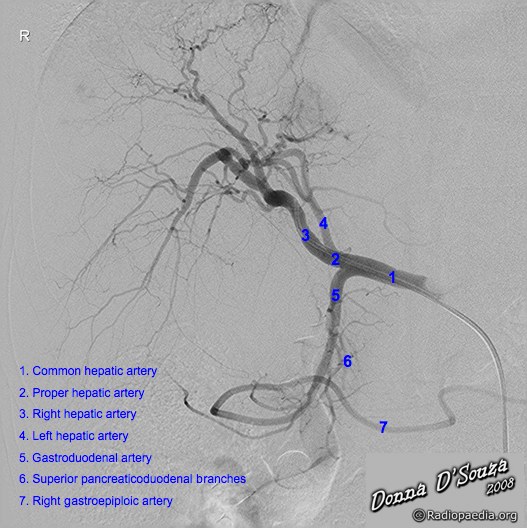
- Localizzare tripode celiaco
- scendere con il catetere lungo la parete aortica iniettando mdc organiodato
- siringa luer-lock 10mL con 7mL di MdC e 3mL di soluzione fisiologica
- scendere con il catetere lungo la parete aortica iniettando mdc organiodato
- Incanulare il tripode celiaco
- Road map del tripode celiaco
- Introdurre filo guida idrofilico (Terumo) attraverso il tripode celiaco fino all'arteria epatica comune
- Portare il catetere su guida all'interno dell'arteria epatica comune
- Fluorografia diagnostica con iniettore
- circa 9mL di MdC con flusso di 3mL/sec
- Rimuovere filo guida
- Road map dell'arteria epatica comune e dei vasi a valle
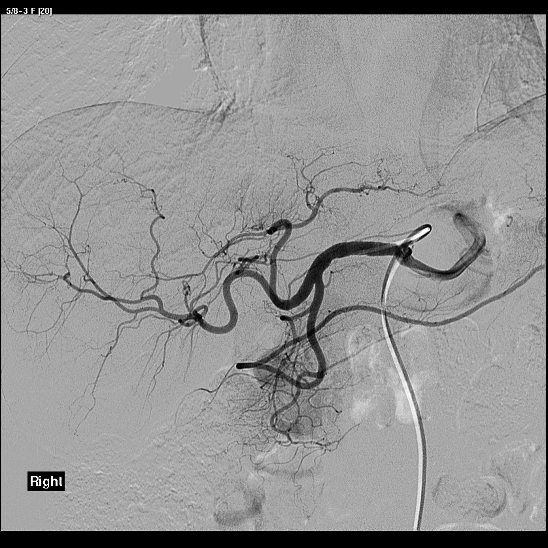
- Utilizzare microcatetere tipo Progreat per incanulare selettivamente i vasi del tumore da trattare
- Diagnostica a mano per visualizzare i vasi da emblolizzare
- Prima di procedere all'embolizzazione è possibile iniettare dal microcatetere 2,5mL di lidocaina e mezza fiala di verapamil (isoptin) 5mg/2mL diluti in 5mL di soluzione fisiologica
- la lidocaina ha funzione anestetica locale
- il verapamil è un calcioantagonista e ha funzione antispastica e vasodilatatoria
- Montare siringa luer-lock da 20mL con mircoparticelle (HepaSphere) perparate con il farmaco su raccordo a tre vie con seconda siringa luer-lock vuota da 20mL sulla seconda via
- Aspirare e rimuovere il surnatante lasciando nella siringa solo il precipitato di microparticelle
- Sostituire la seconda siringa con siringa da 1mL su raccordo tre vie
- da usare per aspirare e poi iniettare il farmaco
- Iniettare sotto controllo in scopia 1mL per volta di microsfere controllando la graduare riduzione di flusso
- Appea il flusso si interroempe si interrompe la somministrazione
- Rimuovere cateteri e filo guida
- Rimozione dell'introduttore con emostasi tramite compressione manuale o sistemi di chiusura
- Medicazione compressiva
Gestione clinica peri-procedurale
- Somministrare indicativamente 50mcg di Fentanyl ad inizio procedura e altri 50mcg di Fentanyl prima dell'inserimento delle particelle embolizzanti trattate con chemioterapico
- in alternativa al fentanyl è possibile somministrare una fiala da 10mg di morfina in 100mL di soluzione fisologica insieme agli altri farmaci subito prima della procedura e una seconda fiala da 10mg di morfina in 100mL di soluzione fisologica a goccia lenta subito dopo il trattamento eventualmente ripetibile ancora una volta al bisogno (attento monitoraggio della funzione respiratoria)
- tipicamente di gestione anstesiologica
- in alternativa al fentanyl è possibile somministrare una fiala da 10mg di morfina in 100mL di soluzione fisologica insieme agli altri farmaci subito prima della procedura e una seconda fiala da 10mg di morfina in 100mL di soluzione fisologica a goccia lenta subito dopo il trattamento eventualmente ripetibile ancora una volta al bisogno (attento monitoraggio della funzione respiratoria)
Post-procedura
- Dopo la procedura il paziente viene ricevorato per osservazione per 1 giorno
Bibliografia
- Merit | HepaSphere
- Kim HC, Chung JW.
Shepherd's hook technique for superselective catheterization of hepatic arteries.
J Vasc Interv Radiol. 2014 Dec;25(12):1993-6.
doi: 10.1016/j.jvir.2014.07.029. Epub 2014 Nov 20. PMID: 25457142.