Termoablazione epatica
- L'indicazione per l'ablazione di un tumore al fegato dovrebbe provenire da una valutazione da parte di un gruppo oncologico multidisciplinare.
- Le dimensioni del tumore (< 3 cm) e la posizione della lesione sono i fattori tecnici più importanti che influenzano il successo dell'ablazione.
- Le complicazioni di grado 2-6 (precedentemente considerate gravi) sono rare, nell'ordine del 2-3%.
- I risultati di sopravvivenza sono significativi, con circa il 70% a 5 anni nella maggior parte delle istologie più favorevoli (HCC, metastasi di NETs).
Indicazioni
- Carcinoma epatocellulare (HCC)
- Nodulo singolo < 2 cm (anche nei pazienti chirurgici)
- Nodulo singolo o fino a 3 noduli < 3 cm nei pazienti non chirurgici (alternativa alla resezione chirurgica basata su fattori tecnici)
- Metastasi epatiche da carcinoma del colon-retto
- Fino a 5 metastasi < 3 cm
- Paziente "non fit" sul piano oncologico
- Pazienti "fit" con tumore inizialmente resecabile, posizione anatomica della lesione sfavorevole o comorbilità sostanziali
- Pazienti "fit" con tumore inizialmente non resecabile, come supplemento alla terapia sistemica
- Colangiocarcinoma intraepatico
- Nodulo singolo < 3 cm nei pazienti non chirurgici
- Metastasi epatiche da tumori neuroendocrini
- Alternativa alla terapia sistemica in caso di malattia oligonodulare
- Metastasi da altri tumori
- Approccio personalizzato, dopo una valutazione da parte di un consiglio oncologico multidisciplinare, adattato alle caratteristiche del paziente, della malattia e dei siti epatici.
Controindicazioni
- Tumore situato a meno di 1 cm dal dotto biliare principale
- rischio di stenosi ritardata del tratto biliare principale
- Presenza significativa di ascite lungo il percorso dell'ago della sonda da ablazione
- potrebbe rappresentare un ostacolo
- Posizione esofitica del tumore quando non è possibile evitare una puntura diretta del tumore
- rischio di disseminazione del tumore.
- Coagulopatia non trattabile o incontrollabile
- potrebbe aumentare il rischio di complicazioni durante l'ablazione.
Materiali
- RFA
- Generatore | Boston Scientific
- Sonda | Boston Scientific LeVeen SuperSlim 3cm x 15cm
- MWA
- Generatore | Helios
- Sonda | Canyon Medical MWA 15G 11mm 200mm (KY-2BAC-24D)
- Generatore | Covidien Emprint
Valutazione pre-procedurale del Paziente
- PT/INR (Tempo di Protrombina/Rapporto Normalizzato Internazionale)
- Raccomandato di routine
- INR deve essere corretto a un valore inferiore a 1,5 o 1,8
- Correggere a < 2,5 nei pazienti con malattia epatica cronica
- Conteggio delle Piastrine/Emoglobina
- Raccomandato routine
- Clopidogrel
- Sospenderlo per 5 giorni prima della procedura
- Aspirina
- Sospenderla per 3-5 giorni prima della procedura
- Eparina frazionata
- Sospendere per 24 ore o fino a due dosi se è stata somministrata una dose terapeutica
- Sospendere una dose se è stata somministrata una dose profilattica
- Warfarin
- Sospenderlo per 5 giorni fino a un INR target di 1,8
- Considerare un'alternativa per i casi ad alto rischio di trombosi
- Se necessario in modo improvviso o emergente, utilizzare un agente di inversione.
Esecuzione della procedura
- Se paziente affetto da diabete mellito eseguire profilassi antibiotica
- Amoxicillina+A.clavulanico (Augmentin 2g ev in 250mL di soluzione fisiologica)
- Posizionare paziente su lettino
- braccia sollevate sopra la testa (se necessario per rendere più facile l'accesso)
- se il paziente ha difficoltà può essere sufficiente il braccio destro
- se disponibile utilizzare materasso a depressione modellabile per adattare la posizione del paziente
- braccia sollevate sopra la testa (se necessario per rendere più facile l'accesso)
- Disinfezione
- Campo sterile
- Valutazione ecografica pre-procedurale
- acquisizione di immagine ecografica pre-procedurale
- valutazione dell'approccio
- valutare geometria della lesione
- escludere la presenza di vasi lungo la traiettoria dell'ago
- mantenere una quota di parenchima epatico sano tra il sito di accesso nel fegato e il margine della lesione
- protegge da un sanguinamento diretto in peritoneo
- valutare le strutture anatomiche contigue
- anse intestinali
- rischio di lesione di parete e perforazione da calore
- diaframma
- struttura innervata, possibile dolorabilità durante l'ablazione
- può richiedere maggior sedazione
- struttura innervata, possibile dolorabilità durante l'ablazione
- pericardio
- valutare la presenza di coronarie (solco atrio-ventricolare)
- possibile somministrazione di 40mg di metilprednisolone (Urbason) in bolo ev come protezione per pericardite e possibile ausilio per controllo del dolore
- se diabetico controllo glicemia
- grossi vasi (quali la vena porta)
- heat-sink effect
- anse intestinali
- valutazione della vascolarizzazione con ecocolordoppler
- Anestesia locale
- 10mL di lidocaina in ecoguida con ago spinale 22G 9mm fino alla capsula epatica
Radiofrequenza (RFA)
Per lesioni target di diametro massimo inferiore ai 3 cm
- Posizionamento dei quattro elettrodi da RFA a livello delle coscie del paziente
- Puntura del traget con ago da radiofrequenza
- posizionare la sonda da radiofrequenza nel centro geometrico della lesione da trattare
- aprire l'apice "ad ombrello" della sonda sul margine distale della lesione
- fare in modo che la lesione si inclusa al di sotto della sonda
- se lesione piccola è possibile non aprire del tutto l'ombrello dell'ombrello da RFA
- ridure l'area di ablazione e aumenta la velocità con cui salirà l'impedenza
- Iniziare primo ciclo di ablazione
- 30W (20W se necessario maggior attenzione rispetto alle caratteristiche del paziente o della sede di lesione), a salire di 10W ogni 30 secondi
- nel caso di lesioni peri-diaframmatiche si può iniziare da 20W per valutare la risposta dolorifica legata alla stimolazione del nervo frenico
- nel caso di procedure in prossimità di struture delicate salire di 5W ogni 30 secondi
- nel caso di lesioni da trattare con maggior attenzione salire di 5W ogni 30 secondi
- nel caso in cui l'impedenza stia salendo troppo rapidamente ridurre di 10W la potenza tra un ciclo e l'altro
- nel momento di crescita esponenziale dell'impendeza interrompere il ciclo
- in generale tra i 20W e i 50W gli effetti di ablazione termica sono pressoché assenti perciò si sale più velocemente di 10W, successivamente gli effetti di ablazione sono maggiori e si rallenta a 5W/30sec per non carbonizzare il tessuto lascaindo però un margine vitale
- 30W (20W se necessario maggior attenzione rispetto alle caratteristiche del paziente o della sede di lesione), a salire di 10W ogni 30 secondi
- Controllo clinico del paziente e valutazione ecografica dell'area di ablazione
- settare la sonda ecografica sulla prima armonica
- valutare lo sviluppo di aria dentro la lesione ablata
- valutare l'assenza di falde liquide periepatiche, possibile espressione di sanguinamento
- Attesa di 1 minuto tra i due cicli
- Secondo ciclo di ablazione
- metà della potenza massima raggiunta durante la prima ablazione
- oppure in alternativa 40W (potenza iniziale della prima ablazione + 10W)
- a salire di 5W ogni 30 secondi
- metà della potenza massima raggiunta durante la prima ablazione
- Tract ablation
- all'aumentare dell'impedenza e diminuire della potenza, raggiunti i 10W chiudere ago da radiofrequenze e uscire per garantire track-ablation protettiva rispetto al seeding
- la tract ablation dovrebbe durare meno di 30 secondi a meno di 100W di potenza con un arretramento di circa 10 secondi per centimentro di tratto
Micronde (MWA)
Valutare l'ago da utilizzare, la potenza e il tempo di erogazione in relazione alle dimensioni della lesione
- Preparare generatore di MWA (procedura nei sistemi Helios)
- collegare 500mL di soluzione fisiologica fredda da frigo (4°C) tramite le due linee di estensione
- nel caso di procedure lunghe sarà necessario sostituire la sacca
- premere tasto "Cooling"
- avvia procedura di raffreddamento della punta dell'ago
- collegare 500mL di soluzione fisiologica fredda da frigo (4°C) tramite le due linee di estensione
- Puntura del traget con sonda da micronde
- posizionare sonda al centro dell elsione in relazione alla geometria di ablazione decisa durante la pianificazione
- Raggiungere il target
- Verificare in longitudinale e in assiale di essere nel centro geometrico della lesione
- Dopo raggiungimento del traget collegare in sterilità la sonda al cavo del generatore
- Avviare il ciclo di abalazione
- Tract ablation
- la tract ablation dovrebbe durare meno di 30 secondi a meno di 100W di potenza con un arretramento di circa 10 secondi per centimentro di tratto
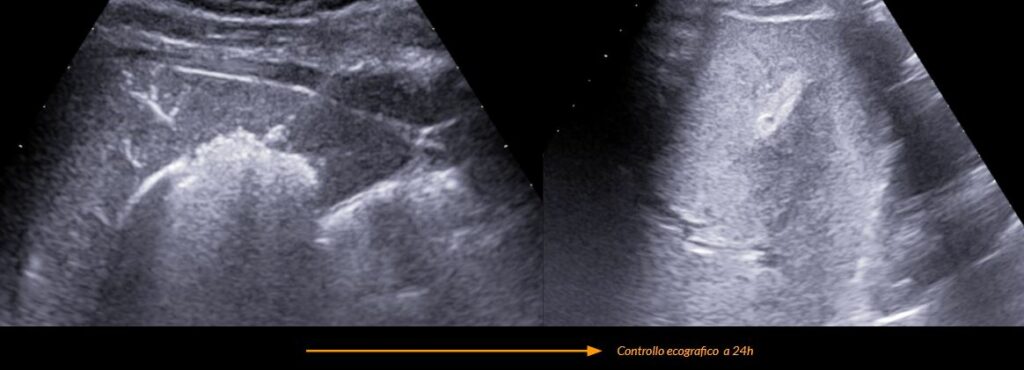
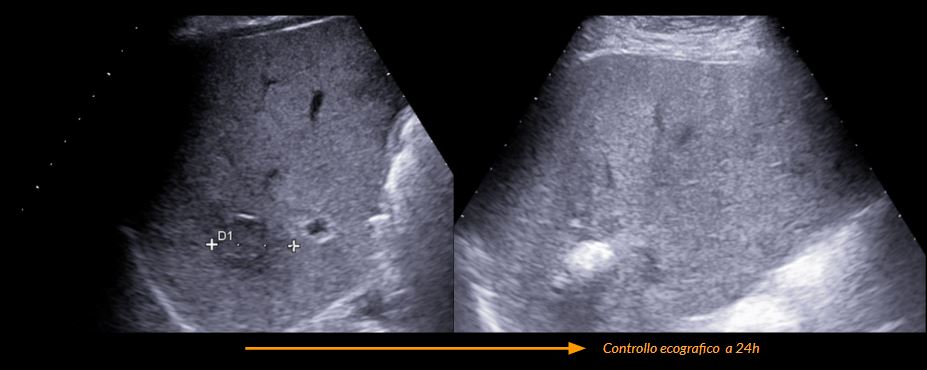
Controllo post-procedurale
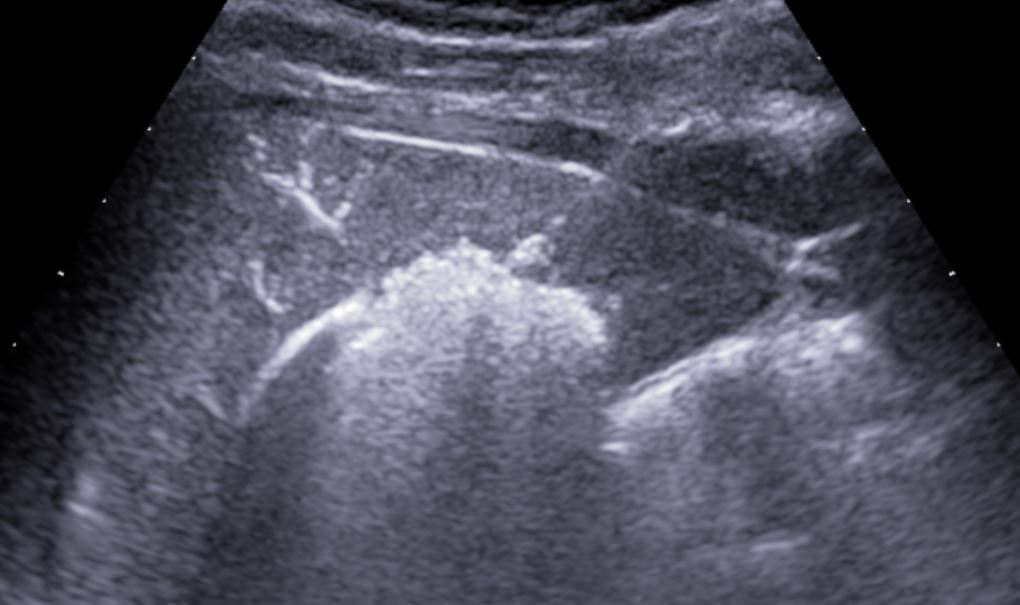
- Controllo ecografico post-procedurale, valutazione ecografica immediata, eventualmente ripetutta dopo 2 ore, al fine di valutare la presenza di:
- acquisizione di immagine ecografica post-procedurale
- valutare l'assenza di:
- raccolta nella tasca del morrison
- raccolta in loggia epatica
- raccolta in loggia splenica
- raccolta nello scavo pelvico
- Paziente in osservazione clinica in regime di allettamento di 2 ore con emocromo di controllo o eventuale ecografia di controllo al sopraggiungere di sintomi
Referto prefatto | Controllo ecografico post-procedurale
Al controllo ecografico a seguito di termoablazione con micoronde della nota lesione epatica del V segmento osservabile focolaio disomogeneo con dimensioni e morfologia pari all'atteso senza segni ecografici di complicanze ascessuali, vascolari o biliari.
Non evidenti raccolte fluide in sede periepatica.
Referti prefatti
TERMOABLAZIONE MWA | ECO / FLUOROGUIDA
Si allega in cartella consenso informato firmato.
Mediante doppia guida ecografica e fluoroscopica si posiziona drenaggio tipo MedItalia 6F in peritoneo a si lascia sacchetto a caduta.
Mediante guida ecografica si esegue ablazione della nota lesione al passaggio S7-S8 con microonde tipo Medtronic Emprint 80W per 2 min 30 sec.
Si aspirano circa 1500ml di liquido citrino dal drenaggio peritoneale.
Si rimuove il drenaggio su guida.
TERMOABLAZIONE RFA | ECOGUIDA CON CEUS | RIPRESA DI HCC SU PRECEDENTE MWA
Consenso informato raccolto in forma scritta e allegato alla cartella clinica.
Sotto guida ecografica, mediante ago-elettrodo del diametro massimo nominale di 3 cm (LeVeen SuperSlim, Boston Scientific), è stata eseguita termoablazione con radiofrequenze della nota area nodulare di ripresa di malattia, del diametro massimo ecografico di circa 18mm, con enhancement vascolare all'approfondimento estemporaneo con mezzo di contrasto ecografico (SonoVue), localizzata sul margine dorso-laterale degli esiti di precedente trattamento con MWA di HCC.
Al controllo ecografico con mezzo di contrasto ecografico al termine della procedura non sono più rilveabili aree di enhancement vascolare, né la formazione ipercogena, in sede di trattamento; non si osservano inoltre raccolte fluide peri-epatiche né a livello della tasca di Morrison.
Nel complesso non si segnalano complicanze peri-procedurali raccomandando comunque periodo di osservazione clinica in regime di allettamento per circa quattro ore con emocromo di controllo tra circa due ore.
TERMOABLAZIONE RFA | ECOGUIDA
Sotto guida ecografica è stata effettuata la termoablazione con radiofrequenze (ago-elettrodo Boston Scientific del diametro massimo nominale di 3 cm) del nodulo di HCC già diagnosticato nel V segmento epatico, in tutta prossimità del letto colecistico, solido lievemente ipoecogeno e a margini altrettanto lievemente lobulati, del diametro massimo di circa 2 cm.
Il controllo ecografico al termine della procedura non ha evidenziato complicanze immediate; si raccomandano comunque allettamento e osservazione clinica fino all'esito dell'emocromo di controllo, da effettuarsi tra circa due ore.
In considerazione del pregresso netto incremento dell'alfa-fetoproteina, infine, è opportuno un nuovo dosaggio della stessa (ma tra non meno di un mese), seguito da TC multifasica a 45 giorni dal trattamento, di cui si prega di comunicare gli esiti.
Termine procedura ore 09:45
TERMOABLAZIONE MWA | ECOGUIDA | RIPRESA DI MALATTIA MTS MAMMELLA SU FEGATO
Sotto guida ecografica, mediante sistema Med-Italia Canyon, è stata effettuata una nuova seduta di
termoablazione con microonde delle note localizzazioni secondarie epatiche, iniziando con la più
piccola nel lobo sinistro, in sede sottoglissoniana superiore (II segmento, del diametro massimo di
circa 1.5 cm; erogazione di 40 W x 4 minuti), per passare a multiple infissioni (100 W per complessivi
di 16 minuti) della voluminosa recidiva prevalente sul versante dorsale/inferiore della zona di ablazione
della pregressa MWA nel VII segmento (diametro massimo di tale progressione tumorale locale
almeno 5 cm).
Il controllo ecografico al termine della procedura non ha evidenziato significative complicanze
immediate, se non un'esile falda fluida interepato-diaframmatica, del volume di pochi ml e stabile in
corso di monitoraggio post-procedurale; si raccomandano pertanto allettamento e osservazione clinica
fino all'esito dell'emocromo di controllo, da effettuarsi tra non più di un'ora.
E' infine opportuna una ristadiazione della malattia, con tempi e modalità da concordarsi con gli
Specialisti Oncologi di riferimento.
Complicazioni
- Sanguinamento
- Emoperitoneo
- Pseudoaneusrima
Gestione clinica peri-procedurale
- 2g di profilassi antibiotica con amoxicillina+acido clavulanico (tipo Augmentin)
- Nei pazienti allergici alle penicilline con peso > 50 kg: 1000mg di vancomicina + 1.5mg/kg di gentamicina
- Se peso <50 kg: 500mg di vancomicina + 1.5mg/kg di gentamicina
- 1g di Paracetamolo (tipo Perfalgan) ev prima della procedura
- Accesso venoso in lavaggio con 500mL di soluzione fisiologica
- in caso di paziente affetto da ipertensione con multiple terapia antipertensive può essere opportuno 500mL di Ringer Acetato
- mezza fiala da 0,1 mg/2mL di fentanil (tipo Fentanest) prima dell'ablazione
- aggiustare in base al peso
- tempo di onset di 5 minuti, 90-120 minuti di risoluzione dell'effetto
- Remifentanil (tipo Ultiva) onset più veloce e 5-15 minuti di risuoluzione dell'effetto
- Stiff-Chest Syndrome / Wooden chest syndrome (rigidità del torace, riduce movimento della cupola epatica)
- si può realizzare dopo minime quanitità di remifentanil
- invece si presenta solo dopo importanti quantità di fentanil (∼3 fiale?)
- Stiff-Chest Syndrome / Wooden chest syndrome (rigidità del torace, riduce movimento della cupola epatica)
- Remifentanil (tipo Ultiva) onset più veloce e 5-15 minuti di risuoluzione dell'effetto
- se necessario revertire con naloxone
- fiale da 0,4mg/mL, portare in 10mL di fisiologica, iniettare lentamente 2mL per volta
- serve a spiazzare l'oppioide quanto basta per recuperare funzione respiratoria senza perderel'effetto analgesico
- fiale da 0,4mg/mL, portare in 10mL di fisiologica, iniettare lentamente 2mL per volta
- come effeto collaterale gli oppioidi possono far prudere il naso al paziente
- massimo 2 fiale da 0,1 mg/2mL di fentanil in procedura
- somministrazione di morfina ev in boli di 2mg con dose massima di (5-10 mg) per controllo del dolore
- l'insufficienza renale può aumentare l'effetto della morfina
- la morfina ha un metabolita attivo (Morfina-6-glucoronide) eliminato per via renale
- non succede nel caso del fentanil
- l'insufficienza renale può aumentare l'effetto della morfina
- Procedure di ablazione in prossimità del fegato possono indure dolore irradiato alla spalla destra per stimolazione del nervo frenico
- in caso di lesioni target di RFA prossimali al diaframma si può partire da 20W invece che 30W
- Se nausea pre procedurale o in paziente con storia di nausea frequente (per es: mal d'auto):
- Somministrare 10mg ev di Metoclopramide (tipo Plasil)
- evitare negli anziani (>80 anni)
- oppure in alternativa 2 fiale da 50mg/2mL di alizapride (tipo Limican)
- negli anziani (>80 anni) somministrare una fiala soltanto
- oppure nel caso di parkinsonismo o altre controindicazioni valutare alternative:
- Ondansetron 4mg (somministrare con 30 min di anticipo)
- oppure in alternativa Granisetron 3mg (somministrare con 30 min di anticipo)
- oppure in alternativa 4mg Desametasone <60kg (oppure fino a 8mg >60kg) endovena 30 minuti prima della procedura con gastroprotettore (omeoprazolo 40mg in 100ml di SF)
- tra i farmaci più efficaci contro il vomito
- In caso di picco ipertensivo (180-200 mmHg) durante l'ablazione è possibile somministrare Urapidil o Lasix ev
- Premedicazione pre-procedurale con clonidina per controllo della pressione e del dolore
Follow-up nel tempo dopo la procedura
- emocromo a 2 ore dalla procedura
- in caso di sintomi o riduzione di 1g/dL di Hb controllo ecografico
- nel caso di importanti riduzioni dell'Hb in pazienti asintomatici controllare ematocrito
- possibile emodiluizione da infusioni
- nel caso di importanti riduzioni dell'Hb in pazienti asintomatici controllare ematocrito
- TC quadrifasica dell'addome (basale+arterioso+venoso+tardivo) di controllo a 40 giorni dopo la procedura
- Successivamente riprende il normale follow-up oncologico
Casi clinici
RIPRESA DI HCC SU MARGINE DI PRECEDENTE MWA
1° ciclio: 30W, ogni 10 secondi salire di 10W
Attesa: 1 minuto
2° ciclo: 30W, ogni 10 secondi salire di 10W
Track-ablation: Quando scende a 10W chiudere e retrarre
HCC 1CM V SEGMENTO PERI-COLECISTICO
1° ciclio: 20W, ogni 10 secondi salire di 10W
Attesa: 1 minuto
2° ciclo: sonda da RFA aperta parzialemente, 20W, ogni 10 secondi salire di 10W
Track-ablation: Quando scende a 10W chiudere e retrarre
MWA SU RIPRESA DI MALATTIA MTS 5CM MAMMELLA SU FEGATO
Doppia infissione su componente ipoecogena ai bordi della lesione.
1° infissione: 100W x 8 minuti
2° infissione: 100W x 5 minuti
MWA SU MTS 18MM PROSSIMALE AL PERICARDIO
1° singola infissione: 40W x 4 minuti
HCC TRATTAMENTO MWA DI RIPRESA DI MALATTIA SU LETTO DI PRECEDENTE ABLAZIONE, LESIONE VOLUMINOSA (>4cm)
1° singola infissione: 80Wx8min (profonda)
Riposizionamento: 80Wx4min (superficiale)
Riposizionamento: 100Wx5min (sede iniziale per ottenere coagulazione arteria epaitica addiacente)
Track ablation: 80Wx10-15sec
MTS EPATICA DA K MAMMELLA (2cm, singola, rotonda) | RFA
1°ciclo: 30W a salire di 10W fino a 70W poi di 5W (brusco incremento dell'impedenza)
2°ciclo: 30W a salire di 10W fino a 70W poi di 5W
Retrazione dell'ago: visto il brusco incremento di impedenza al primo ciclo viene deciso di retrare al termine dei primi due cicli e riaprire medialmente al centro della lesione per evitare ripresere di malattia sulla cupola.
3°ciclo: 30W a salire di 10W fino a 70W poi di 5W
4°ciclo: 30W a salire di 10W fino a 70W poi di 5W
Tract ablation: raggiunti i 10W si chiude e si ritrae lentamente
MTS EPATICA DA K MAMMELLA (3cm, polilobata, ovalare) | MWA
1° singola infissione: 100Wx10min
Bibliografia
- Crocetti L, Baére T de, Pereira PL, Tarantino FP
CIRSE Standards of Practice on Thermal Ablation of Liver Tumours
CardioVascular and Interventional Radiology. 2020;43(7):951–62
https://doi.org/10.1007/s00270-020-02471-z