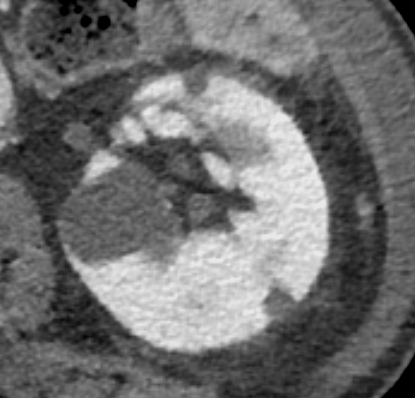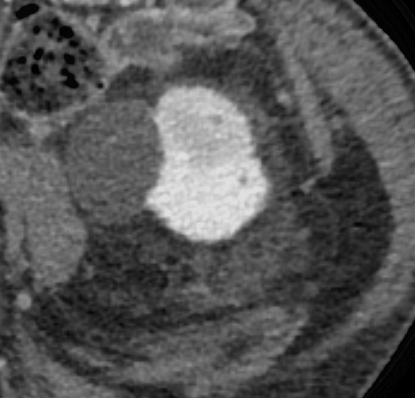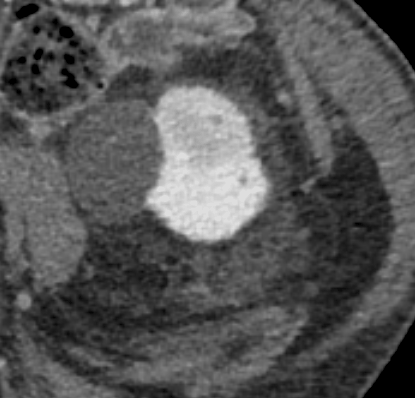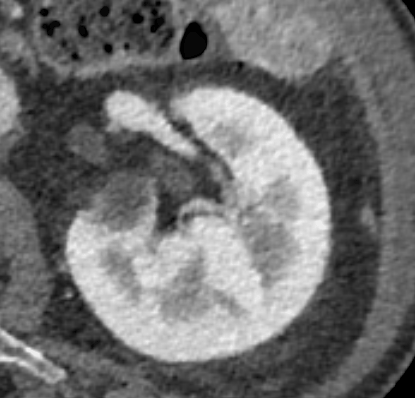
Termoablazione renale
- L'ablazione percutanea rappresenta un'alternativa alla chirurgia per il trattamento dei RCC di stadio T1a
- I risultati tecnici e funzionali della procedura sono eccellenti
- Il tasso di complicanze è molto basso
- La procedura è minimamente invasiva e può essere eseguita sotto sedazione e in regime ambulatoriale
- I pazienti che possono essere sottoposti a trattamento con ablazione percutanea sono quelli con punteggi ASA da 1 a 3
- I dati di follow-up oncologico a 5 anni sono eccellenti
Gli istotipi del tumore renale sono classificati secondo la Classificazione di Vancouver
Indicazioni
- alternativa alla chirurgia per il trattamento dei RCC di stadio T1a
- presenza di comorbilità che aumenterebbero il rischio dell'intervento chirurgico
- COPD avanzata
- insufficienza cardiaca
- monorene funzionale
- funzione renale compromessa
- GFR < 60 ml/min per 1,73 m2
- multipli tumori renali di dimensioni ridotte
- scelta del paziente di non sottoporsi ad un intervento chirurgico
- presenza di comorbilità che aumenterebbero il rischio dell'intervento chirurgico
Controindicazioni
Controindicazioni assolute
- Coagulopatia non correggibile
Controindicazioni relative
- Deformità spinale estesa che non permetterebbe l'accesso percutaneo alla lesione
Esecuzione della procedura
- Nel rene si fa sempre profilassi antibiotica
- 2g di ceftiaxone (rocefin) in 250mL di soluzione fisiologica
- Posizionare paziente su lettino
- posizionare paziente con il fianco della lesione sollevato
- braccio sollevate sopra la testa (se necessario per rendere più facile l'accesso)
- se il paziente ha difficoltà può essere sufficiente il braccio destro
- se disponibile utilizzare materasso a depressione modellabile per adattare la posizione del paziente
- Disinfezione
- Campo sterile
- Valutazione ecografica pre-procedurale
- acquisizione di immagine ecografica pre-procedurale
- valutazione dell'approccio
- valutare geometria della lesione
- escludere la presenza di vasi lungo la traiettoria dell'ago
- valutare le strutture anatomiche contigue
- anse intestinali
- rischio di lesione di parete e perforazione da calore
- parenchima epatico
- anse intestinali
- valutazione della vascolarizzazione con ecocolordoppler
- Anestesia locale
- 10mL di lidocaina in ecoguida con ago spinale 22G 9mm fino al rene
- Nel caso di anse intestinali addiacenti (intestino tenute/colon) si può eseguire idrodissezione
- con ago spinale e siringa luer da 20 mL iniettare soluzione fisiologica sterile in spazio perirenale per allontanare le anse (da 20mL fino a 200-500mL)
- in TC si può ricorrere a dissezione con aria
Radiofrequenza (RFA)
Per lesioni target di diametro massimo inferiore ai 3 cm
- Posizionamento dei quattro elettrodi da RFA a livello delle coscie del paziente
- Puntura del traget con ago da radiofrequenza
- posizionare la sonda da radiofrequenza nel centro geometrico della lesione da trattare
- aprire l'apice "ad ombrello" della sonda sul margine distale della lesione
- fare in modo che la lesione si inclusa al di sotto della sonda
- se lesione piccola è possibile non aprire del tutto l'ombrello dell'ombrello da RFA
- ridure l'area di ablazione e aumenta la velocità con cui salirà l'impedenza
- Iniziare primo ciclo di ablazione
- 30W (20W se necessario maggior attenzione rispetto alle caratteristiche del paziente o della sede di lesione), a salire di 10W ogni 30 secondi
- quando l'impedenza inizia a salire (incremento di 2-3ohm) iniziare a salire più lentamente di soli 5W ogni 30s
- nel caso in cui l'impedenza stia salendo troppo rapidamente ridurre di 10W la potenza tra un ciclo e l'altro
- quando l'impedenza inizia a salire (incremento di 2-3ohm) iniziare a salire più lentamente di soli 5W ogni 30s
- nel caso di procedure in prossimità di struture delicate salire di 5W ogni 30 secondi
- nel caso di lesioni da trattare con maggior attenzione salire di 5W ogni 30 secondi
- nel momento di crescita esponenziale dell'impendeza interrompere il ciclo
- 30W (20W se necessario maggior attenzione rispetto alle caratteristiche del paziente o della sede di lesione), a salire di 10W ogni 30 secondi
- Controllo clinico del paziente e valutazione ecografica dell'area di ablazione
- settare la sonda ecografica sulla prima armonica
- valutare lo sviluppo di aria dentro la lesione ablata
- valutare l'assenza di falde liquide periepatiche, possibile espressione di sanguinamento
- Attesa di 1 minuto tra i due cicli
- Secondo ciclo di ablazione
- metà della potenza massima raggiunta durante la prima ablazione
- oppure in alternativa 40W (potenza iniziale della prima ablazione + 10W)
- a salire di 5W ogni 30 secondi
- metà della potenza massima raggiunta durante la prima ablazione
- Tract ablation
- all'aumentare dell'impedenza e diminuire della potenza, raggiunti i 10W chiudere ago da radiofrequenze e uscire per garantire track-ablation protettiva rispetto al seeding
- la tract ablation dovrebbe durare meno di 30 secondi a meno di 100W di potenza con un arretramento di circa 10 secondi per centimentro di tratto
Micronde (MWA)
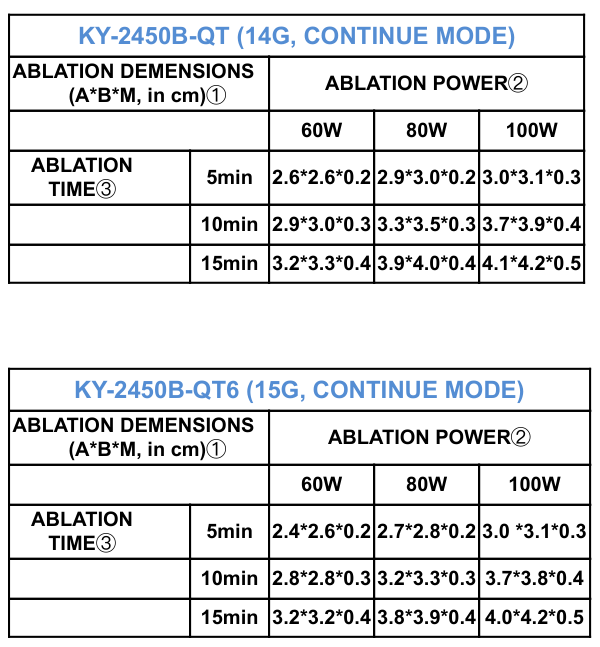
Valutare l'ago da utilizzare, la potenza e il tempo di erogazione in relazione alle dimensioni della lesione
- Puntura del traget con sonda da micronde
Controllo post-procedurale
- Controllo ecografico post-procedurale, valutazione ecografica immediata, eventualmente ripetutta dopo 2 ore, al fine di valutare la presenza di:
- acquisizione di immagine ecografica post-procedurale
- valutare l'assenza di:
- raccolta nella tasca del morrison
- raccolta in loggia epatica
- raccolta in loggia splenica
- raccolta nello scavo pelvico
- Paziente in osservazione clinica in regime di allettamento di 2 ore con emocromo di controllo o eventuale ecografia di controllo al sopraggiungere di sintomi
Referti prefatti
Consenso informato raccolto in forma scritta e allegato al presente referto.
Previa anestesia locale con 10mL di lidocaina, sotto guida ecografica con ago semiautomatico Tru-Cut 18G si esegue agobiopsia della nota piccola massa renale lievemente ipoecogena a morfologia ovalare e sviluppo esofitico localizzata a livello della corticale del rene di sinistra (2 prelievi) seguita da termoablazione con radiofrequenze mediante ago-elettrodo (Boston Scientific LeVeen SuperSlim di diametro massimo nominale di 3 cm).
Il materiale prelevato alla biopsia è stato inviato alla valutazione anatomo-patologica.
Il controllo ecografico al termine della procedura non ha evidenziato complicanze immediate.
Termine procedura ore 13:30
Controllo post-procedura
- Controllo ecografico post-procedurale, valutazione ecografica immediata, eventualmente ripetutta dopo 2 ore, al fine di valutare la presenza di:
- acquisizione di immagine ecografica post-procedurale
- valutare l'assenza di:
- raccolta nella tasca del morrison
- raccolta in loggia epatica
- raccolta in loggia splenica
- raccolta nello scavo pelvico
- Paziente in osservazione clinica in regime di allettamento di 2 ore con emocromo di controllo o eventuale ecografia di controllo al sopraggiungere di sintomi
Complicazioni
- Sanguinamento
- Lesione o stenosi dell'uretere o del giunto ureteropelvico
- Perforazione dell'intestino
- Infezione/ascesso
- Lesione dei nervi sensoriali o motori
- Pneumotorace
- Seeding lungo il tracciato dell'ago
- Ustione cutanea
Casi clinici
RFA DI DUE LESIONI RENALI (PRIMA CENTIMETRICA SU MARGINE DI CICATRICE CHIRURGICA PER PREGRESSO TUMORE RENALE, SECONDA SUBCENTIMETRICA CON COMPONENTE FLUIDA)
Profilassi con 2g di ceftriaxone in SF
Piccola lesione renale destra di difficile approccio, accesso trans-epatico per avere una afeguata finestra ecografica.
RFA LeVeen 3cm.
Prima lesione
1°ciclo: 30W, salire di 5W ogni 30 secondi,
1 minuto di attesa
2° ciclo: 20W, salire di 10W ogni 30 secondi fino a 50W, poi di 5W ogni 30 secondi (a 55W si va a picco di impedenza e si retrae con track-ablation)
Seconda piccola lesione (possibile componenete liquida, maggiore è la componenete liquida tanto più velocimente sale la temperatura e volecemente avviene la bruciatura)
1° ciclo: 20W, ogni 30 secondi si sale di 10W
1 minuto di attesa
2° ciclo: 10W, salire di 5W ogni 30 secondi, ragigunti circa 50W (a 55W si va a picco di impedenza e si retrae con track-ablation)
RFA DI SINGOLA LESIONE ISOECOGENA CORTICALE MANTELLARE 18mm
Biopsia pre-procedurale in tandem dopo aver posizionato ago da RFA per eventuale emostasi
1° ciclo: 20W, ogni 30 secondi si sale di 10W (raggiunti 70W)
1 minuto di attesa
2° ciclo: 20W, salire di 10W ogni 30 secondi (picco di impedenza e si retrae con track-ablation)
RFA DI RIPRESA DI MALATTIA RENALE RESIDUA RCC 4cm IN PLURIMI SITI
1° ciclo: 30W, ogni 30 secondi si sale di 10W (raggiunti 100W) salire di 5W ogni 30s
1 minuto di attesa
2° ciclo: 30W, salire di 10W ogni 30 secondi, incremento di impedenza a 50W da lì salire di 5W (picco di impedenza a 70W)
1 minuto di attesa
3° ciclo: 30W, salire di 10W ogni 30 secondi, incremento di impedenza a 50W da lì salire di 5W (picco di impedenza a 70W)
Appunti
- Termoablazione renale
- Questo tipo di procedura include
- ablazioni a RadioFrequenze (RF)
- crioablazioni
- opzioni terapeutiche proponibili nel caso di comparsa di ‘piccola massa renale’ in:
- Pazienti fragili
- grandi anziani
- con comorbidità
- in cui è controindicata l’anestesia o la chirurgia
- mantiene ad oggi tassi minori in termini:
- sia di recidive/progressioni di malattia
- sia di mortalità
- spesso come alternativa alla sorveglianza attiva
- tipicamente “mal vista” dal Paziente
- E’ chiaro che l’approccio terapeutico migliore rimane quello “tailor made”
- deciso in un MultiDisciplinary Team (MDT) composto da
- urologi
- radiologi (diagnostici ed interventisti)
- oncologi
- patologi
- ma anche nefrologi,
- chirurghi oncologici
- anestesisti
- radioterapisti
- a tal proposito è corretto da Specialisti ‘indicare la via’ al Paziente
- scrivendo nei referti il corretto iter
- e non liquidarlo con la classica affermazione ‘meritevole di approfondimento specialistico urologico’ al massimo ‘specialistico multidisciplinare’
- facendo tuttavia attenzione al grande numero di Linee Guida in cui le varie specialità propongono indicazioni più in linea con la competenza della propria branca
- deciso in un MultiDisciplinary Team (MDT) composto da
- Nella maggior parte dei casi, nel management della piccola massa renale
- non si sta curando una malattia oncologica che mette a rischio la vita del Paziente,
- bensì si sta cercando di preservare il più a lungo possibile la funzionalità renale
- Le maggiori innovazioni nella gestione delle masse renali sono state fatte tuttavia nel campo della malattia avanzata
- per via delle innovazioni farmacologiche
- qui di seguito vengono riportate le principali (non le più aggiornate) dell’AUA (‘American Urological Association’) con evidenziate le indicazioni alla termoablazione
- non si sta curando una malattia oncologica che mette a rischio la vita del Paziente,
- Una cosa su cui si concorda è il fatto che
- in tumori tra i 3 cm ed i 4 cm
- le terapie ablative presentino tutt’oggi maggior rischio di ‘Malattia Residua’
- quindi malattia persistente o ricorrente
- rispetto alle tecniche resettive chirurgiche
- le terapie ablative presentino tutt’oggi maggior rischio di ‘Malattia Residua’
- ancora peggio per le masse > 4 cm
- occorre quindi fare un corretto counseling con il Paziente
- elencando correttamente i rischi ed i benefici delle tecniche termoablative
- informandolo anche di come sia possibile eseguire un ulteriore trattamento ablativo nel caso di recidive di malattia
- in tumori tra i 3 cm ed i 4 cm
- Se si analizzano tutte le Linee Guida sopraindicate
- si nota come manchino degli studi randomizzati
- che confrontino i risultati delle termoablazioni e delle resezioni sui T1a
- non solo nei Pazienti fragili
- o con controindicazioni chirurgiche-anestesiologiche
- ma anche nei Pazienti chirurgicamente fit
- allo stato attuale sono presenti score
- per calcolare il rischio di morte e di complicanze post- procedurali
- in RCC corticali < 7 cm
- che confrontano
- nefrectomia radicale
- nefrectomia parziale
- termoablazione
- sorveglianza attiva
- partendo dall’analisi
- dell’età,
- del sesso,
- del BMI,
- dell’eGFR,
- dell’ECOG performance status,
- del Charlson comorbidity index del Paziente
- dal diametro della massa tumorale
- che confrontano
- in RCC corticali < 7 cm
- per calcolare il rischio di morte e di complicanze post- procedurali
- allo stato attuale sono presenti score
- non solo nei Pazienti fragili
- che confrontino i risultati delle termoablazioni e delle resezioni sui T1a
- si nota come manchino degli studi randomizzati
- Quantitativo stimato di perdita di tessuto renale sano post-trattamento
- cosiddetto danno d’organo
- si sappia che
- post-nefrectomie “selettive” laparoscopiche/robotiche esso è pari al 15-20%
- mentre dopo procedure ablative se ne perde al massimo il 3-5%
- si sappia che
- cosiddetto danno d’organo
- Questo tipo di procedura include
Bibliografia
- Krokidis ME, Orsi F, Katsanos K, Helmberger T, Adam A.CIRSE Guidelines on Percutaneous Ablation of Small Renal Cell Carcinoma.
Cardiovasc Intervent Radiol. 2017 Feb;40(2):177–91.