Lyrica è un farmaco a base del principio attivo Pregabalin, appartenente alla categoria degli Antiepilettici e nello specifico Gabapentinoidi. E' commercializzato in Italia dall'azienda Mylan Italia S.r.l..
Lyrica può essere prescritto con Ricetta RNR - medicinali soggetti a prescrizione medica da rinnovare volta per volta.
- Lyrica viene utilizzato per trattare il dolore cronico causato da un danno del sistema nervoso. Diverse malattie possono causare dolore neuropatico periferico, come il diabete o l’herpes zoster. Le sensazioni di dolore possono essere descritte come calore, bruciore, pulsazioni, dolori pulsanti, dolori lancinanti, dolori acuti, dolori crampiformi, sofferenza, formicolio, intorpidimento, dolori pungenti. Il dolore neuropatico periferico e centrale può anche essere associato ad alterazioni dell’umore, disturbi del sonno e fatica (stanchezza) e può avere un impatto sull’attività fisica e sociale e sulla qualità della vita complessiva.
- Lyrica viene utilizzato per trattare alcune forme di epilessia negli adulti (attacchi epilettici parziali con o senza generalizzazione secondaria). Il medico le prescriverà Lyrica per aiutarla nel trattamento dell’epilessia quando il trattamento già in corso non controlla la situazione. Dovrà assumere Lyrica in aggiunta al trattamento cui è già sottoposto. Lyrica non viene utilizzato da solo, ma deve essere sempre associato ad altri trattamenti antiepilettici.
- Lyrica viene utilizzato per il trattamento del Disturbo d’Ansia Generalizzata (GAD). I sintomi del Disturbo d’Ansia Generalizzata sono caratterizzati da un’ansia e preoccupazione eccessive e prolungate che sono difficili da controllare. Il Disturbo d’Ansia Generalizzata può causare anche irrequietezza o una sensazione di tensione o di avere i nervi a fior di pelle, stanchezza, difficoltà di concentrazione o vuoti di memoria, irritabilità, tensione muscolare o alterazioni del sonno.
Confezioni
Lyrica 100 mg 21 capsule rigide
Lyrica 150 mg 14 capsule rigide
Lyrica 150 mg 56 capsule rigide
Lyrica 25 mg 14 capsule rigide
Lyrica 300 mg 56 capsule rigide
Lyrica 50 mg 21 capsule rigide
Lyrica 75 mg 14 capsule rigide
Lyrica 75 mg 56 capsule rigide
Lyrica 150 mg 14 capsule rigide
Lyrica 150 mg 56 capsule rigide
Lyrica 25 mg 14 capsule rigide
Lyrica 300 mg 56 capsule rigide
Lyrica 50 mg 21 capsule rigide
Lyrica 75 mg 14 capsule rigide
Lyrica 75 mg 56 capsule rigide
Informazioni commerciali sulla prescrizione
Titolare: Upjohn EESV
Concessionario: Mylan Italia S.r.l.
Ricetta: RNR - medicinali soggetti a prescrizione medica da rinnovare volta per volta
Classe: A
Principio attivo: Pregabalin
Gruppo terapeutico: Antiepilettici
ATC: N02BF02 - Pregabalin
Forma farmaceutica: capsula
Concessionario: Mylan Italia S.r.l.
Ricetta: RNR - medicinali soggetti a prescrizione medica da rinnovare volta per volta
Classe: A
Principio attivo: Pregabalin
Gruppo terapeutico: Antiepilettici
ATC: N02BF02 - Pregabalin
Forma farmaceutica: capsula
Indicazioni
Dolore neuropatico
Lyrica è indicato per il trattamento del dolore neuropatico periferico e centrale negli adulti.
Epilessia
Lyrica è indicato come terapia aggiuntiva negli adulti con attacchi epilettici parziali in presenza o in assenza di generalizzazione secondaria.
Disturbo d'ansia generalizzata
Lyrica è indicato per il trattamento del Disturbo d'Ansia Generalizzata (GAD) negli adulti.
Posologia
Posologia
La dose varia da 150 a 600 mg al giorno, suddivisa in due o tre somministrazioni.
Dolore neuropatico
Il trattamento con Pregabalin può essere iniziato alla dose di 150 mg al giorno suddivisa in due o tre somministrazioni. In base alla risposta individuale ed alla tollerabilità del paziente, la dose può essere aumentata a 300 mg al giorno dopo un intervallo da 3 a 7 giorni e, se necessario, può essere aumentata ad una dose massima di 600 mg al giorno dopo un ulteriore intervallo di 7 giorni.
Epilessia
Il trattamento con pregabalin può essere iniziato alla dose di 150 mg al giorno suddivisa in due o tre somministrazioni. In base alla risposta individuale ed alla tollerabilità del paziente, dopo 1 settimana la dose può essere aumentata a 300 mg al giorno. La dose massima di 600 mg al giorno può essere raggiunta dopo un'ulteriore settimana.
Disturbo d'ansia generalizzata
La dose è 150-600 mg al giorno da somministrare in due o tre somministrazioni. La necessità del trattamento deve essere rivalutata regolarmente.
Il trattamento con pregabalin può essere iniziato alla dose di 150 mg al giorno. In base alla risposta individuale ed alla tollerabilità del paziente, dopo 1 settimana la dose può essere aumentata a 300 mg al giorno. Dopo un'ulteriore settimana la dose può essere aumentata a 450 mg al giorno.
La dose massima di 600 mg al giorno può essere raggiunta dopo un'ulteriore settimana.
Sospensione del trattamento con pregabalin
In accordo all'attuale pratica clinica, se il trattamento con pregabalin deve essere sospeso, indipendentemente dall'indicazione, si raccomanda di effettuare la sospensione del trattamento in modo graduale nell'arco di almeno 1 settimana (vedere paragrafi 4.4 e 4.8).
Compromissione renale
Pregabalin viene eliminato dalla circolazione sistemica principalmente mediante escrezione renale sotto forma di farmaco immodificato. Poiché la clearance di pregabalin è direttamente proporzionale alla clearance della creatinina (vedere paragrafo 5.2), la riduzione della dose di pregabalin in pazienti con compromissione della funzionalità renale deve essere personalizzata in base alla clearance della creatinina (CLcr), come indicato nella Tabella 1 applicando la seguente formula:
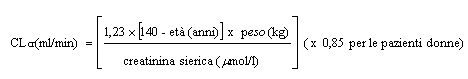
Pregabalin viene eliminato in modo efficace dal plasma mediante emodialisi (50 % del farmaco in 4 ore). Per i pazienti sottoposti ad emodialisi, il dosaggio giornaliero di pregabalin deve essere corretto in base alla funzionalità renale. In aggiunta alla dose giornaliera, un'ulteriore dose di pregabalin deve essere somministrata subito dopo ogni seduta di dialisi della durata di 4 ore (vedere Tabella 1).
Tabella 1. Aggiustamento della Dose di Pregabalin in Base alla Funzionalità Renale
|
Clearance della creatinina (CLcr)
(ml/min)
|
Dose totale giornaliera di pregabalin*
|
Regime posologico
|
|
|
Dose iniziale (mg/die)
|
Dose massima (mg/die)
|
||
|
≥ 60
|
150
|
600
|
BID o TID
|
|
≥ 30 - < 60
|
75
|
300
|
BID o TID
|
|
≥ 15 - < 30
|
25 – 50
|
150
|
Una volta al giorno o BID
|
|
< 15
|
25
|
75
|
Una volta al giorno
|
|
Dose supplementare a seguito di emodialisi (mg)
|
|||
|
25
|
100
|
Dose singola +
|
|
TID = Tre somministrazioni
BID = Due somministrazioni
* La dose totale giornaliera (mg/die) deve essere suddivisa come indicato dal regime posologico per ottenere la singola dose prevista in mg
+ La dose supplementare è una singole dose aggiuntiva
Compromissione epatica
Non è necessario un aggiustamento posologico in pazienti con compromissione epatica (vedere paragrafo 5.2).
Popolazione pediatrica
La sicurezza e l'efficacia di Lyrica nei bambini di età inferiore a 12 anni e negli adolescenti (12-17 anni) non è ancora stata stabilita. I dati attualmente disponibili sono descritti nei paragrafi 4.8, 5.1 e 5.2 ma non è possibile formulare una raccomandazione per la posologia.
Anziani
Nei pazienti anziani può essere necessaria una riduzione della dose di pregabalin a causa di una riduzione della funzionalità renale (vedere paragrafo 5.2).
Modo di somministrazione
Lyrica può essere assunto con o senza cibo.
Lyrica è solo per uso orale.
Controindicazioni
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
Avvertenze speciali e precauzioni di impiego
Pazienti diabetici
In accordo all'attuale pratica clinica, in alcuni pazienti diabetici che aumentano di peso durante il trattamento con Pregabalin può essere necessario modificare il dosaggio dei medicinali ipoglicemizzanti.
Reazioni di ipersensibilità
Nella fase di commercializzazione del medicinale sono state segnalate reazioni di ipersensibilità, inclusi casi di angioedema. Il trattamento con pregabalin deve essere immediatamente interrotto in presenza di sintomi di angioedema come gonfiore del viso, gonfiore periorale o gonfiore delle vie respiratorie superiori.
Capogiri, sonnolenza, perdita di conoscenza, confusione e compromissione mentale
Il trattamento con pregabalin è stato associato a capogiri e sonnolenza che possono aumentare, nei pazienti anziani, il rischio di lesioni accidentali (cadute). Sono stati inoltre segnalati casi di perdita di conoscenza, confusione e compromissione mentale. Pertanto, si dovrà consigliare ai pazienti di fare attenzione fino a quando non avranno familiarizzato con i potenziali effetti di questo medicinale.
Effetti relativi alla vista
Nei trials controllati, in una percentuale superiore di pazienti trattati con pregabalin rispetto ai pazienti trattati con placebo è stato segnalato un offuscamento della vista che si è risolto, nella maggior parte dei casi, con il proseguimento del trattamento. Negli studi clinici in cui è stato effettuato un test oftalmologico, l'incidenza di riduzione dell'acuità visiva e di alterazioni del campo visivo è stata maggiore nei pazienti in trattamento con pregabalin rispetto a quelli trattati con placebo; l'incidenza delle alterazioni rilevate all'esame fondoscopico è stata invece maggiore nei pazienti in trattamento con placebo (vedere paragrafo 5.1).
Reazioni avverse a carico della vista, tra cui perdita della vista, offuscamento della vista o altre alterazioni dell'acuità visiva, molte delle quali transitorie, sono state segnalate anche nella fase di commercializzazione del medicinale. La sospensione del trattamento con pregabalin può portare ad una risoluzione o ad un miglioramento di questi sintomi della vista.
Insufficienza renale
Sono stati segnalati casi di insufficienza renale e in alcuni casi l'interruzione del trattamento con pregabalin ha messo in evidenza che questa reazione avversa è reversibile.
Sospensione del trattamento con altri medicinali antiepilettici
Non ci sono dati sufficienti in base ai quali, una volta ottenuto il controllo degli attacchi epilettici mediante assunzione di pregabalin in terapia aggiuntiva, si possa sospendere il trattamento concomitante con altri medicinali antiepilettici e mantenere la monoterapia con pregabalin.
Sintomi da astinenza
In alcuni pazienti, a seguito della sospensione di trattamenti a breve e a lungo termine con pregabalin sono stati osservati sintomi da astinenza. Sono stati segnalati i seguenti eventi: insonnia, cefalea, nausea, ansia, diarrea, sindrome influenzale, nervosismo, depressione, dolore, convulsioni, iperidrosi e capogiri, suggestivi di dipendenza fisica. I pazienti devono essere informati di questa evenienza prima dell'inizio del trattamento.
Durante il trattamento con pregabalin o subito dopo l'interruzione del trattamento, possono verificarsi convulsioni, incluso stato epilettico e crisi convulsive di tipo grande male.
Per quanto riguarda l'interruzione del trattamento a lungo termine con pregabalin, i dati suggeriscono che l'incidenza e la gravità dei sintomi da sospensione possano essere correlati alla dose.
Insufficienza cardiaca congestizia
Durante la fase di commercializzazione del medicinale sono stati segnalati casi di insufficienza cardiaca congestizia in alcuni pazienti in trattamento con pregabalin. Queste reazioni si osservano principalmente in pazienti anziani con malattia cardiovascolare in trattamento con pregabalin per il dolore neuropatico. Pregabalin deve essere utilizzato con cautela in questi pazienti. La sospensione del trattamento con pregabalin può risolvere questa condizione.
Trattamento del dolore neuropatico centrale dovuto ad una lesione del midollo spinale
Nel trattamento del dolore neuropatico centrale dovuto ad una lesione del midollo spinale l'incidenza delle reazioni avverse in generale, delle reazioni avverse del sistema nervoso centrale azioni del sistema nervoso centrale e della sonnolenza in particolare, è aumentata. Ciò può essere attribuito ad un effetto aggiuntivo causato dai medicinali concomitanti (p.es. agenti anti-spastici) necessari per questa patologia. Ciò deve essere tenuto in considerazione quando pregabalin viene prescritto in questa patologia.
Ideazione e comportamento suicidari
Casi di ideazione e comportamento suicidari sono stati riportati nei pazienti in trattamento con medicinali antiepilettici nelle loro diverse indicazioni. Una meta-analisi di studi randomizzati e controllati verso placebo eseguiti con farmaci antiepilettici ha inoltre evidenziato un lieve incremento del rischio di ideazione e comportamento suicidari. Il meccanismo di tale rischio non è noto e i dati disponibili non escludono la possibilità di un aumentato rischio durante il trattamento con pregabalin.
Pertanto, i pazienti devono essere monitorati per la comparsa di segni di ideazione e comportamento suicidari e un appropriato trattamento deve essere preso in considerazione. I pazienti (e coloro che se ne prendono cura) devono essere avvisati di consultare il medico nel caso in cui emergano segni di ideazione o comportamento suicidari.
Ridotta funzionalità del tratto gastrointestinale inferiore
Sono stati riportati eventi correlati ad una ridotta funzionalità del tratto gastrointestinale inferiore (p.es. ostruzione intestinale, ileo paralitico, stipsi) quando pregabalin è stato somministrato insieme ai medicinali che possono causare stipsi, come gli analgesici oppioidi. Quando pregabalin e gli oppioidi vengono utilizzati in associazione, si possono prendere in considerazione misure preventive della stipsi (in particolare nelle donne e nei soggetti anziani).
Uso improprio, abuso potenziale, o dipendenza
Sono stati segnalati casi di uso improprio, abuso e dipendenza. È necessario fare attenzione in pazienti con storia di abuso di sostanze e il paziente deve essere monitorato per la possibile insorgenza di sintomi di uso improprio, abuso o dipendenza da pregabalin (sono stati riportati casi di sviluppo di tolleranza, aumento della dose, comportamento di ricerca compulsiva del farmaco).
Encefalopatia
Sono stati segnalati casi di encefalopatia, per la maggior parte in pazienti con condizioni di base che possono far precipitare un'encefalopatia.
Intolleranza al lattosio
Lyrica contiene lattosio monoidrato. I pazienti affetti da rari problemi ereditari di intolleranza al galattosio, da deficit di Lapp lattasi, o da malassorbimento di glucosio-galattosio, non devono assumere questo medicinale.
Interazioni con altri medicinali e altre forme di interazione
Poiché pregabalin viene principalmente escreto immodificato nella urine, subisce un metabolismo trascurabile nell'uomo (< 2% di una dose si ritrova nelle urine sotto forma di metaboliti), non inibisce il metabolismo dei farmaci in vitro e non si lega alle proteine plasmatiche, è improbabile che causi o subisca interazioni farmacocinetiche.
Studi in vivo e analisi farmacocinetica sulla popolazione
Di conseguenza, negli studi in vivo non sono state osservate interazioni farmacocinetiche clinicamente rilevanti tra pregabalin e fenitoina, carbamazepina, acido valproico, lamotrigina, gabapentin, lorazepam, ossicodone o etanolo. L'analisi farmacocinetica sulla popolazione ha indicato che antidiabetici orali, diuretici, insulina, fenobarbital, tiagabina e topiramato non hanno avuto un effetto clinicamente significativo sulla clearance del pregabalin.
Contraccettivi orali noretisterone e/o etinilestradiolo
La somministrazione concomitante di pregabalin con i contraccettivi orali noretisterone e/o etinilestradiolo non influenza la farmacocinetica delle due sostanze allo steady-state.
Prodotti medicinali con effetto sul sistema nervoso centrale
Pregabalin può potenziare gli effetti di etanolo e lorazepam. In studi clinici controllati, dosi orali multiple di pregabalin somministrato con ossicodone, lorazepam o etanolo non hanno avuto effetti clinicamente importanti sulla respirazione. Durante la fase di commercializzazione del medicinale sono stati segnalati casi di insufficienza respiratoria e coma in pazienti in trattamento con pregabalin ed altri medicinali che deprimono il sistema nervoso centrale (SNC). Sembra che pregabalin abbia un effetto additivo sulla compromissione della funzione cognitiva e sulla funzione motoria causate dall'ossicodone.
Interazioni nei pazienti anziani
Non sono stati condotti specifici studi di interazione farmacodinamica in volontari sani anziani. Studi di interazione sono stati condotti solo negli adulti.
Fertilità, gravidanza e allattamento
Donne in età fertile/Contraccezione negli uomini e nelle donne
Poichè non è ancora conosciuto il potenziale rischio nell'uomo, le donne in età fertile devono utilizzare un metodo di contraccezione efficace.
Gravidanza
Non sono disponibili dati adeguati sull'uso di Pregabalin in donne in gravidanza.
Studi condotti sull'animale hanno dimostrato tossicità riproduttiva (vedere paragrafo 5.3). Non è noto il potenziale rischio per l'uomo. Lyrica non deve essere utilizzato durante la gravidanza a meno che non sia chiaramente necessario (se il beneficio per la madre è chiaramente superiore al potenziale rischio per il feto).
Allattamento
Pregabalin è escreto nel latte materno (vedere paragrafo 5.2). L'effetto di pregabalin su neonati/lattanti è sconosciuto. Si deve decidere se interrompere l'allattamento o interrompere la terapia con pregabalin tenendo in considerazione il beneficio dell'allattamento per il bambino e il beneficio della terapia per la donna.
Fertilità
Non ci sono dati clinici sugli effetti del pregabalin sulla fertilità femminile.
In uno studio clinico per valutare l'effetto del pregabalin sulla motilità dello sperma, pazienti maschi sani sono stati esposti ad una dose di pregabalin di 600 mg/giorno. Dopo 3 mesi di trattamento non sono stati evidenziati effetti sulla motilità dello sperma.
Uno studio di fertilità nelle femmine di ratto ha dimostrato delle reazioni avverse nella riproduzione.
Lo studio di fertilità nei maschi di ratto ha dimostrato reazioni avverse nella riproduzione e nello sviluppo. La rilevanza clinica di queste patologie è sconosciuta (vedere paragrafo 5.3).
Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
Lyrica può avere un'influenza minima o moderata sulla capacità di guidare e usare macchinari. Lyrica può causare capogiri e sonnolenza e pertanto può influenzare la capacità di guidare veicoli o usare macchinari. Si deve consigliare ai pazienti di non guidare, utilizzare macchinari complessi o intraprendere altre attività potenzialmente pericolose fino a quando non sarà noto se questo medicinale influenza la loro capacità di svolgere queste attività.
Effetti indesiderati
Il programma clinico di Pregabalin ha coinvolto oltre 8900 pazienti trattati con pregabalin; di questi pazienti oltre 5600 sono stati arruolati in studi clinici controllati in doppio cieco verso placebo. Le reazioni avverse segnalate più comunemente sono state capogiri e sonnolenza. Le reazioni avverse sono state di solito di intensità lieve-moderata. In tutti gli studi controllati, la percentuale di interruzione per reazioni avverse è stata del 12 % per i pazienti in trattamento con pregabalin e del 5 % per quelli in trattamento con placebo. Le reazioni avverse più comuni che hanno comportato l'interruzione del trattamento con pregabalin sono state capogiri e sonnolenza.
Nella tabella 2 sottostante sono elencate tutte le reazioni avverse che si sono verificate con un'incidenza maggiore del placebo ed in più di un paziente e sono classificate per classe sistemica organica e per frequenza (molto comune (≥ 1/10), comune (≥ 1/100, < 1/10), non comune (≥ 1/1.000, < 1/100), raro (≥ 1/10.000, < 1/1.000), molto raro (< 1/10.000), non nota (la frequenza non può essere definita sulla base dei dati disponibili). All'interno di ciascuna classe di frequenza, gli effetti indesiderati sono riportati in ordine di gravità decrescente.
Le reazioni avverse elencate possono essere associate anche alla malattia di base e/o all'impiego di medicinali concomitanti.
Nel trattamento del dolore neuropatico centrale dovuto ad una lesione del midollo spinale l'incidenza delle reazioni avverse in generale, delle reazioni del SNC e della sonnolenza in particolare, è aumentata (vedere paragrafo 4.4).
Altre reazioni segnalate durante la fase di commercializzazione del medicinale sono incluse in corsivo nella lista sottostante
Tabella 2. Reazioni avverse da pregabalin
|
Classificazione per sistemi e organi
|
Reazioni avverse
|
|
Infezioni ed infestazioni
|
|
|
Comune
|
Nasofaringite
|
|
Patologie del sistema emolinfopoietico
|
|
|
Non comune
|
Neutropenia
|
|
Disturbi del sistema immunitario
|
|
|
Non comune
Raro
|
Ipersensibilità
Angioedema, reazione allergica
|
|
Disturbi del metabolismo e della nutrizione
|
|
|
Comune
|
Aumento dell'appetito
|
|
Non comune
|
Anoressia, ipoglicemia
|
|
Disturbi psichiatrici
|
|
|
Comune
|
Euforia, confusione, irritabilità, disorientamento, insonnia, riduzione della libido
|
|
Non comune
|
Allucinazioni, attacchi di panico, irrequietezza, agitazione, depressione, umore depresso, innalzamento del tono dell'umore, aggressività, alterazioni dell'umore, depersonalizzazione, difficoltà nel trovare le parole, sogni alterati, aumento della libido, anorgasmia, apatia
|
|
Raro
|
Disinibizione
|
|
|
|
|
Patologie del sistema nervoso
|
|
|
Molto comune
|
Capogiri, sonnolenza, cefalea
|
|
Comune
|
Atassia, coordinazione alterata, tremori, disartria, amnesia, compromissione della memoria, disturbi dell'attenzione, parestesia, ipoestesia, sedazione, disturbi dell'equilibrio, letargia
|
|
Non comune
|
Sincope, stupor, mioclono, perdita di coscienza, iperattività psicomotoria, discinesia, capogiri posturali, tremore intenzionale, nistagmo, disturbi cognitivi, compromissione mentale, alterazioni del linguaggio, iporeflessia, iperestesia, sensazione di bruciore, ageusia, malessere
|
|
Raro
|
Convulsioni, parosmia, ipocinesia, disgrafia
|
|
|
|
|
Patologie dell'occhio
|
|
|
Comune
|
Offuscamento della vista, diplopia
|
|
Non comune
|
Perdita della visione periferica, disturbi della vista, gonfiore oculare, disturbi del campo visivo, riduzione dell'acuità visiva, dolore oculare, astenopia, fotopsia, secchezza oculare, aumento della lacrimazione, irritazione oculare
|
|
Raro
|
Perdita della vista, cheratite, oscillopsia, alterata percezione della profondità visiva, midriasi, strabismo, luminosità visiva
|
|
|
|
|
Patologie dell'orecchio e del labirinto
|
|
|
Comune
|
Vertigini
|
|
Non comune
|
Iperacusia
|
|
Patologie cardiache
|
|
|
Non comune
|
Tachicardia, blocco atrioventricolare di primo grado, bradicardia sinusale, insufficienza cardiaca congestizia
|
|
Raro
|
Prolungamento dell'intervallo QT, tachicardia sinusale, aritmia sinusale
|
|
|
|
|
Patologie vascolari
|
|
|
Non comune
|
Ipotensione, ipertensione, vampate di calore, rossore (flushing), sensazione di freddo a livello periferico
|
|
Patologie respiratorie, toraciche e mediastiniche
|
|
|
Non comune
|
Dispnea, epistassi, tosse, congestione nasale, rinite, russare, secchezza nasale
|
|
Raro
|
Edema polmonare, senso di costrizione alla gola
|
|
|
|
|
Patologie gastrointestinali
|
|
|
Comune
|
Vomito, nausea, stipsi, diarrea, flatulenza, distensione addominale, secchezza della bocca
|
|
Non comune
|
Malattia da reflusso gastroesofageo, ipersecrezione salivare, ipoestesia orale
|
|
Raro
|
Ascite, pancreatite, gonfiore della lingua,disfagia
|
|
Patologie epatobiliari
|
|
|
Non comune
|
Enzimi del fegato elevati*
|
|
Raro
|
Ittero
|
|
Molto raro
|
Insufficienza epatica, epatite
|
|
Patologie della cute e del tessuto sottocutaneo
|
|
|
Non comune
|
Rash papulare, orticaria, iperidrosi, prurito
|
|
Raro
|
Sindrome di Stevens-Johnson, sudori freddi
|
|
|
|
|
Patologie dell'apparato muscoloscheletrico e tessuto connettivo
|
|
|
Comune
Non comune
|
Crampi muscolari, artralgia, dolore alla schiena, dolore agli arti, spasmi del tratto cervicale
Gonfiore delle articolazioni, mialgia, contrazioni muscolari, dolore al collo rigidità muscolare
|
|
Raro
|
Rabdomiolisi
|
|
Patologie renali e urinarie
|
|
|
Non comune
|
Incontinenza urinaria, disuria
|
|
Raro
|
Insufficienza renale, oliguria, ritenzione urinaria
|
|
|
|
|
Patologie dell'apparato riproduttivo e della mammella
|
|
|
Comune
|
Disfunzione erettile
|
|
Non comune
|
Disfunzione sessuale, ritardo nell'eiaculazione, dismenorrea, dolore al seno
|
|
Raro
|
Amenorrea, secrezione mammaria, ingrandimento del seno, ginecomastia
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
|
|
Comune
|
Edema periferico, edema, anomalie dell'andatura, cadute, sensazione di ubriachezza, sentirsi strani, spossatezza
|
|
Non comune
|
Edema generalizzato, edema facciale, costrizione del torace, dolore, piressia, sete, brividi, astenia
|
|
|
|
|
Esami diagnostici
|
|
|
Comune
|
Aumento di peso
|
|
Non comune
|
Aumento della creatinfosfochinasi ematica, aumento della glicemia, riduzione della conta piastrinica, aumento della creatinina ematica, riduzione della potassiemia, riduzione di peso
|
|
Raro
|
Riduzione del numero dei globuli bianchi
|
* Aumento della alanina amino transferasi (ALT), aumento dell'aspartato aminotransferasi (AST).
In alcuni pazienti, a seguito della sospensione di trattamenti a breve e a lungo termine con pregabalin sono stati osservati sintomi da sospensione. Sono state segnalate le seguenti reazioni: insonnia, cefalea, nausea, ansia, diarrea, sindrome influenzale, convulsioni, nervosismo, depressione, dolore, iperidrosi e capogiri, suggestivi di dipendenza fisica. I pazienti devono essere informati di questa evenienza prima dell'inizio del trattamento.
Per quanto riguarda l'interruzione del trattamento a lungo termine con pregabalin, i dati suggeriscono che l'incidenza e la gravità dei sintomi da sospensione possano essere correlati alla dose.
Popolazione pediatrica
Il profilo di sicurezza di pregabalin osservato in tre studi pediatrici in pazienti con crisi epilettiche parziali con o senza generalizzazione secondaria (studio di sicurezza ed efficacia di 12 settimane in pazienti con crisi epilettiche parziali, n=295; studio di farmacococinetica e tollerabilità, n=65 e studio di estensione in aperto di 1 anno per la sicurezza, n=54) era simile a quello osservato negli studi sugli adulti di pazienti con epilessia. Gli eventi avversi più comuni osservati nello studio di 12 settimane con il trattamento con pregabalin sono stati sonnolenza, piressia, infezione delle vie respiratorie superiori, appetito aumentato, peso aumentato e nasofaringite (vedere paragrafi 4.2, 5.1 e 5.2).
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all'indirizzo http://www.agenziafarmaco.gov.it/content/come-segnalare-una-sospetta-reazione-avversa.
Sovradosaggio
Durante la fase di commercializzazione del medicinale, le reazioni avverse più comunemente osservate quando Pregabalin è stato assunto a dosi superiori a quelle raccomandate hanno incluso sonnolenza, stato confusionale, agitazione e irrequietezza. Sono state riportate anche crisi convulsive.
In rare occasioni, sono stati riportati casi di coma.
Il trattamento del sovradosaggio di pregabalin deve includere misure generali di supporto e, se necessario, può includere l'emodialisi (vedere paragrafo 4.2 Tabella 1).
Scadenza
3 anni.
Conservazione
Questo medicinale non richiede alcuna speciale condizione di conservazione.
Elenco degli eccipienti
Lyrica 25 mg, 50 mg, 150 mg capsule rigide
Contenuto delle capsule:
Lattosio monoidrato
Amido di mais
Talco
Opercolo delle capsule:
Gelatina
Diossido di titanio (E171)
Sodio laurilsolfato
Silice colloidale anidra
Acqua depurata
Inchiostro:
Shellac
Ossido di ferro nero (E172)
Glicole propilenico
Potassio idrossido
Lyrica 75 mg, 100 mg, 200 mg, 225 mg, 300 mg capsule rigide
Contenuto delle capsule:
Lattosio monoidrato
Amido di mais
Talco
Opercolo delle capsule:
Gelatina
Diossido di titanio (E171)
Sodio laurilsolfato
Silice colloidale anidra
Acqua depurata
Ossido di ferro rosso (E172)
Inchiostro:
Shellac
Ossido di ferro nero (E172)
Glicole propilenico
Potassio idrossido
Farmaci Equivalenti
I farmaci equivalenti di Lyrica a base di Pregabalin sono: Aclaton, Algecia, Ecubalin, Gabex, Gaviria, Lyrica, Pregabalin Accord, Pregabalin Alter, Pregabalin Aristo, Pregabalin Aurobindo, Pregabalin Doc Generici, Pregabalin EG Stada Italia, Pregabalin HCS, Pregabalin Mylan, Pregabalin Pensa, Pregabalin Sandoz - Capsula, Pregabalin Sun, Pregabalin Tecnigen, Pregabalin Teva Italia, Pregabalin Zentiva - Capsula, Prelynca, Regalbax, Rumbot, Utufar
Foglietto Illustrativo
Raccolta di immagini
Non sono state rilevate immagini associate all'espressione
"Lyrica"
puoi provare a cercare con un'altra parola chiave oppure consultare l'Atlante di Radnote
puoi provare a cercare con un'altra parola chiave oppure consultare l'Atlante di Radnote